
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
15.Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов.
15. Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов.
Катализом называют явление изменения скорости химической реакции под воздействием катализаторов. Реакции, протекающие с участием катализаторов, называют каталитическими.
Гомогенный – это такой катализ, когда катализатор и все реагирующие вещества находятся в одной фазе.
Гомогенный катализ в растворах наиболее часто вызывается действием водородных и гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом. Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряются действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость.
Главным положением гомогенного катализа является представление о том, что в ходе реакции образуются неустойчивые промежуточные соединения катализатора с реагирующими веществами, которые затем распадаются с регенерацией катализатора
К гомогенному катализу относятся многие реакции кислотно-основного взаимодействия, реакции комплексообразования, многочисленные реакции гидрирования, сульфидирования, реакции, катализированные ферментами.
К гетерогенным относятся каталитические процессы, протекающие на границе раздела фаз Т-Г, Т-Ж. При гетерогенном катализе реакция протекает на поверхности катализатора. Поэтому площадь поверхностного слоя катализатора и его строение определяют активность катализатора.
Гетерогенный катализ находит большее применение в промышленности, чем гомогенный.
В качестве гетерогенных катализаторов используют переходные металлы, металлы первой группы, фосфорную кислоту.
Чаще всего для анализа кинетических схем ферментативного катализа используют метод стационарных концентраций (k2 > > k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен:
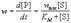 где wmax = k2. [E]0 - максимальная скорость реакции (при бесконечно большой концентрации субстрата),
где wmax = k2. [E]0 - максимальная скорость реакции (при бесконечно большой концентрации субстрата),

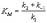 - константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1
- константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1
Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ - катализаторов. Катализаторы участвуют в реакции, но в результате ее не расходуются. Катализаторы биологических процессов, протекающих в живых организмах, представляют собой белковые молекулы, которые называют ферментами, или энзимами.
|
16Понятие биогенности хим. элементов. Классиф. биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы. Основные источники поступления примесных элементов в организм человека. Химические аспекты окружающей среды. Биогенные элементы – элементы, необходимые для построения и жизнедеятельности различных клеток и организмов. Биосфера – часть земной оболочки, занятая растительными и животными организмами. Среда, организованная определённым образом, переработанная живыми организмами и космическими излучениями и приспособленная к жизни (по В. И. Вернадскому) Кларки элементов - - числовые оценки средних содержаний химических элементов в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк может быть выражен в единицах массы (%, г/т и др. ) либо в атомных %. Термин " кларк" введен А. Е. Ферсманом, назван по имени Ф. У. Кларка. Биологическое концентрирование элемента – увеличенное содержание элемента в организме по сравнению с окружающей средой. Непропорциональное содержание элементов в организме и среде связано с тем, что усвоение элементов влияет растворимость их природных соединений в воде. Органогены – систем (C, Н, О, N, Р, S) только 6 элементов, составляющих основу живых. Они составляют в организме 97, 4% Элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме. Микроэлементы – (I, Cu, As, F, Br, St, Ba, Co) их содержание в организме находится в пределах от 10-3 до 10-5 %. |
Примесные элементы - биологическая роль не выяснена до конца. Их делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F).
21-22Константа растворимости. Условия образования и растворения осадков. Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальциевого буфера. Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов
|
17. -20Изоэлектрическая точка. 19. Буферное действие - основной механизм протолитического гомеостаза организма. Механизм действия буферных систем, их количественные характеристики. Расчет рН протолитических систем. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая. Понятие о кислотно-основном состоянии организма. Роль реакции гидролиза в биохимических процессах. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др. ).
Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называют протолитическими. Понятия «кислота» и «основание» являются относительными, так как одни и те же объекты могут проявлять как кислотные, так и основные свойства в зависимости от партнера по равновесию. Конкуренция за обладание протоном делает кислотно-оснoвную реакцию обратимой и приводит ее к состоянию протолитического равновесия с определенным значением константы равновесия Kс при T = Const. Частицы, способные к взаимодействию как с кислотами, так и соснованиями, называются амфолитами.. Типичным примером амфолитов являются аминокислоты. Сила кислот определяется их способностью отдавать протон, а оснований — принимать его. Мерой этой способности служат соответственно константа кислотности Кa и константа основности Кb.
Изоэлектрическая точка - точка нулевого заряда, состояние поверхности тела (или частицы дисперсной фазы) в контакте с раствором электролита, характеризующееся равным числом положительных и отрицательных зарядов в адсорбционном слое. Буферная система — это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при определенных внешних воздействиях. Протолитические буферные системы поддерживают постоянство рН при добавлении небольших количеств кислот и оснований. Раствор, содержащий одну или несколько буферных систем, называется буферным раствором. Буферные растворы имеют две главные количественные характеристики — рН и буферную емкость β. При выборе буферного раствора для проведения анализа или эксперимента руководствуются необходимой величиной рН среды и способностью ее сохранять это значение при внесении кислот или оснований. Если раствор содержит только одну буферную систему, то для расчета рН и β следует использовать отношение а и сумму с концентраций компонентов буферной системы НВ/В (знаки зарядов частиц НВ и В для разных типов систем разные): Тогда рН раствора, содержащего буферную систему, определяется уравнением
Буферное действие раствора измеряется буферной емкостью, т. е. тем количеством щелочи или кислоты, которое требуется прибавить к 1 л раствора, чтобы значение его рН изменилось на единицу. Буферная емкость измеряется количеством кислоты или щелочи (моль или ммоль эквивалентов), добавление которого к 1 л буферного раствора изменяет рН на единицу. Способность раствора поддерживать определенное значение рН называется буферным действием. Буферным действием обладают: 1. Система слабая кислота – ее соль с сильным основанием, а также сочетание кислой и средней солей слабых кислот или двух кислых солей. 2. Система слабое основание – его соль с сильной кислотой: 3. Ионы и молекулы амфолитов – аминокислотные и белковые системы. Буферные системы крови обеспечивают поддержание относительного постоянства активной реакции крови, т. е. осуществляют регуляцию кислотно-щелочного состояния. В крови имеется 4 буферных системы: 1)бикарбонатная— угольная кислота-двууглекислый натрий (Н2СО3 — НаНСО3), 2)фосфатная — одноосновный-двуосновный фосфорнокислый натрий (НаН2РО4— На2НРО4); 3) гемоглобиновая— восстановленный гемоглобин-калийная соль гемоглобина (ННв-КНвО2); 4) буферная система белков плазмы. В поддержании буферных свойств крови ведущая роль принадлежит гемоглобину и его солям (около 75%), в меньшей степени бикарбонатному, фосфатному буферам и белкам плазмы. Белки плазмы играют роль буферной системы, благодаря своим амфотерным свойствам.Гидролиз (греч. hydor вода + lysis разложение) – разложение веществ, проходящее с обязательным участием воды и протекающее по схеме: AB + H-OH → AH + BOH Без этого процесса не было бы возможным усвоение пищевых продуктов, так как высасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться Реакциями нейтрализации - реакции получения солей смешиванием кислоты и основания. Вот примеры реакций нейтрализации: NaOH + HCl = NaCl + H2O (для получения хлорида натрия); 2NaOH + H2SO4 = Na2SO4 + 2H2O (для получения сульфата натрия); Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O (для получения нитрата кальция); |
В фармации применяют для количественного анализа неорганических кислот — соляной, серной, борной и органических кислот — уксусной, бензойной, винной, лимонной, салициловой. В биофармацевтических исследованиях методом нейтрализации определяют рКа кислот и рКb оснований, так как по значению этих величин можно прогнозировать способность лекарственных препаратов проходить через биологические мембраны.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|

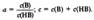
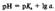
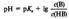 или
или