
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп атайды.
Кен орнының ө ндірістік қ ұ ндылығ ы оның ө лшемдерімен ғ ана анық талып қ оймай, ол айтарлық тай дә режеде коллекторлардың физикалық қ асиеттерін, қ абат сұ йық тылығ ын газдардың, сонымен қ атар қ абат энергиясының тү рімен, қ орымен де анық талады.
Ө німді қ абаттың геологиялық, ө ндірістік сипаттамасы.
Бұ л қ абаттың қ ұ рамы механикалық қ асиеті, мұ най, газ жә не суғ а қ анық тылығ ы. Гранулометрлік қ ұ рамы – қ ыртыстағ ы бө лшектердің мө лшері. Гранулометрлік қ ұ рамына қ ыртыстың коллекторлық қ асиеті тә уелді болады.
Тау жыныстарының кеуектілігі.
Тау жыныстарының кеуектілігі деп, онда қ атты заттардың толық тырылмағ ан бостық тарының бар болуын тү сіндіреді.
Толық кеуектілік коэффициенті деп - барлық қ уыстар V  кө лемінің қ осындысының, жыныстардың кө леміне V қ атынасын айтамыз,
кө лемінің қ осындысының, жыныстардың кө леміне V қ атынасын айтамыз,
яғ ни m= 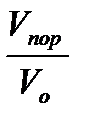
Жыныстардың толық кезекшілік коэффициентін мұ найдың қ орын бағ алау кезінде, сонымен қ атар қ абаттардың немесе сол қ абаттардың бө лімдерін салыстыру ү шін қ олданады.
Ортаның қ асиеттері, айтарлық тай дә режеде қ уысты арналардың ө лшемдерімен анық талады.
Олар:
1) Жоғ ары капиллярлы – диаметрі 0, 5 мм.
2) капиллярлы – диаметрі 0, 0002- 0, 5 мм
3) субкаппиллярлы – диаметрі 0, 0002 мм-ден кіші арналар жатады. Қ ұ рамында мұ най болатын жыныстарды сипаттау ү шін толық кеуектіліктен басқ а, оның ашық кеуектілік коэффициентін енгізеді. Кейбір тау жыныстарының толық кеуектілік коэффициенті:
саз балшық ты тақ татастар – 0, 54 – 1, 4 %;
саз балшық тар – 6-50 %; қ ұ мдар – 6-52 %;
ә к тас пен доломиттер – 0, 65-33 %;
Жыныстардың кеуектілігінің кең шекті ө згеруі олардың пішіні, ө лшемі бойынша тү йіршіктердің біртекті еместігі, цементтелу ү рдісі, тұ здардың шө гуі мен еруі жә не т. б.
Тау жыныстарының ө ткізгіштігі
Тау жыныстарының ө ткізгіштігі деп – сұ йық тар мен газдардың сү зілу қ абілетін тү сінеді. Халық аралық ө лшем системасында ө ткізгіштің ө лшем бірлігі ретінде кө лденең қ имасының ауданы 1 м 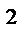 жә не ұ зындығ ы 1 м қ ысым тү суі 1 π а кезіндегі ү лгі арқ ылы сү зілуі кезінде, тұ тқ ырлығ ы 1 π а-с сұ йық шығ ыны 1 м
жә не ұ зындығ ы 1 м қ ысым тү суі 1 π а кезіндегі ү лгі арқ ылы сү зілуі кезінде, тұ тқ ырлығ ы 1 π а-с сұ йық шығ ыны 1 м 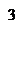 /с қ ұ райтын ортаның ө ткізгіштігін қ абылдайды.
/с қ ұ райтын ортаның ө ткізгіштігін қ абылдайды.
Кә сіпшілік істе ө ткізгішті бағ алау ү шін ә детте Дарсидың практикалық ө лшемін қ олданады, ол 1м 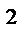
 ө ткізгішке қ арағ анда 10
ө ткізгішке қ арағ анда 10  есе кіші.
есе кіші.
Мұ най жә не газ кенорындарын игеру кезінде қ уысты ортада мұ най, газ, су немесе мұ най-су-газ қ оспа қ озғ алады. Қ озғ алатын зат жә не қ озғ алу сипаты қ андай екеніне байланысты, сол бір ортаның ө ткізгіштігі ә ртү рлі болуы мү мкін. Сондық тан қ ұ рамында мұ най болатын жыныстардың ө ткізгіштігін сипаттау ү шін абсолютті, тиімді жә не салыстырмалы ө ткізгіштік деген ұ ғ ымды енгізеді.
Абсолютті ө ткізгіштік – деп қ уысты орта тек қ ана қ арастырып отырғ ан фазамен толтырылды деген жағ дайда, тек қ андай да бір фазаның сү зілуі байқ алатын қ уыс ортаның ө ткізгіштігі айтылады.
Тиімді ө ткізгіштік – қ уыстың қ ұ рамында кө п фазалы жү йенің болуы кезінде берілген газ жә не сұ йық ү шін жыныстың ө ткізгіштігі аталады.
Қ уысты ортаны салыстырмалы ө ткізгіштігі деп - осы ортаның тиімді ө ткізгіштігінің абсолюттікке қ атынасын айтады.
20% суғ а қ анығ уы кезінде жыныстың ө ткізгіштігі мұ най ү шін тө мендейді, ал 85%-ғ а су қ анығ уы кезінде мұ най ө ткізгіштігі мү лдем тоқ тайды. Мұ ндай кү йді, ол – молекулалар беттік жә не капиллярлы кү штермен берік ұ сталып тұ рады да ү лкен емес қ ысым тү суі кезінде қ озғ алыссыз қ ала береді. Арналардың қ имасы кішірейеді де, мұ най ү шін ө ткізгіштің азаюына ә кеп соқ тырады.
Мұ най жә не су тұ тқ ырлығ ының қ атынасы суғ а қ анығ удан фазалық ө ткізгіштің байланыстылығ ына онша ә сер етпейді, бірақ ө суіне қ арай қ уысты ортаның тұ рақ ты суғ а қ анығ уы кезінде ағ ындағ ы мұ найдың салыстырмалы мө лшері қ ысқ арады.
Ө ткізгіштік – бұ л қ ысым ө згерген сайын, кө лемнің ө згеруін сипаттайды.
Мұ най сің іргіштік – жер қ ыртысындағ ы мұ най қ орын білдіреді. Бұ л қ орды мұ най толтырылғ ан кө лем орын басады. Қ абаттағ ы жағ дайда мұ найдың тығ ыздығ ы қ ысымнан, температурадан жә не еріген газ кө леміне байланысты ө згереді. Қ ысым ұ лғ айғ ан сайын мұ найдың тығ ыздығ ы да ұ лғ ая бастайды. Ал температура мен еріген газ кө лемі ұ лғ айғ ан сайын тығ ыздық мә ні азаяды. Мұ най ө ндіру кеніштерінде 10-30%-қ а дейін будың кө лемде, ал газ кеніштерінде тығ ыздығ ы тө мен коллекторларда – 70%.
Осындай айтылғ ан мұ найды, газды жә не сұ йық тарды қ абатта ұ стап тұ рғ ан кү штердің кедергісін жойып, сұ йық тарды қ озғ алту ә дістемелері, коллектордың мұ най бергіштігін кө бейту ә дістерінің негізіне жатады.
Жер қ ойнауының қ абат қ ысымы жә не температурасы
Мұ най жә не газ қ ұ нарлы қ абаттың қ уыстарында орналасып, қ абаттың қ ысымы жә не температура жерімен жұ мыс жасайды. Жер астындағ ы мұ най мен газдың немесе сұ йық тық тың қ ұ рамы. Сұ йық тық =мұ най+газ+су. Сұ йық тық тың ө зіне тә н энергиясы болады. Табиғ и энергияның негізі болып мұ най мен газдың бү йірінде немесе табанында орналасқ ан қ абат суларының ағ ыны болып саналады. Қ абат суының ағ ыны неғ ұ рлым жоғ ары болса, жер қ ойнауынан мұ най қ оры кө бірек ө ндіріледі. Қ абатты ұ ң ғ ымамен ашқ анғ а дейін потенциалдық энергия сақ талады. Ал одан ө нім ала бастағ ан соң, потенциалдық энергия жү йесі бұ зылып, тұ рақ сыз кинетикалық энергияғ а айналады. Жер бетіне сұ йық тық кө теріледі. Сұ йық тық ішінде мұ наймен бірге ілеспе газда шығ ады. Қ абат қ ысымы тө мендейді. Жалпы қ абат қ ысымы жә не сұ йық тық дең гейі жасамай тұ рғ ан немесе арнайы тоқ татылғ ан ұ ң ғ ымада ө лшенеді.
Қ абат қ ысымы –кеніш бойының мұ най-газ ө ндіру жұ мыстары басталмай тұ рғ анда немесе ұ ң ғ ыма сағ асында артық қ ысым болмағ ан кезде қ абат қ ысымының мө лшері сол кеніштің терең дігіне тә уелді болады. Қ абат қ ысымын келесі формуламен анық таймыз:
Р қ аб-қ =Hpg (1. 1)
Мұ ндағ ы: H –қ абат терең дігі, ө лшем бірлігі [м].
P –ұ ң ғ ыма ішіндегісұ йық тың тығ ыздығ ы, ө лшем бірілігі [кг/м3].
G –еркін тү су ү деуі, ө лшем бірлігі [м/сек2].
Р – Паскаль. Қ абат қ ысымы [Па].
Қ абат қ ысымының ауыспалы болуына температураның да жері мол, себебі температураның ө суімен байланысты кү рделі кө мірсутектері ажырап, ұ сақ танып бірнеше молекулаларғ а бө лініп, жалпы кө лемін ө сіреді. Осығ ан орай сұ йық тық пен газдың кө лемі ұ лғ аяды, қ абат қ ысымы артады. Тә жірибеде, ө ндірісте қ абат қ ысымы монометр арқ ылы ө лшенеді. Ұ ң ғ ыма бойындағ ы сұ йық тық пен газдың тығ ыздығ ы белгілі болғ ан жағ дайда жә не ұ ң ғ ыма сағ асында артық қ ысым болса, қ абат қ ысымының шамасы тө мендегі формуламен анық талады:
Рқ аб-қ =Hpg+Pсағ а. (1. 2)
Мұ ндағ ы: Рсағ а-ұ ң ғ ыманың сағ асындағ ы қ ысым, ө лшем бірлігі [Па].
Мұ най мен газдың қ абат шартындағ ы физикалық жағ дайы.
Жер қ ойнауындағ ы мұ найдың физикалық жағ дайын оны жер бетіне шығ арғ андағ ы қ асиетімен салыстыруғ а болмайды. Себебі жер астында мұ най температура жә не қ абат қ ысымына байланысты сақ талады, ал оны жер ү стіне шығ арғ анда температура тө мендейді, қ ысым жойылады, мұ найдан газ бө лініп шығ ады. Мұ найдың кө лемі кішірейді.
Мұ найдың қ абат бойындағ ы қ асиеттерін білу, ә сіресе мұ най қ орын есептеу мұ най ө ндірудің технологиялық ү лгілерін орындау, техникалық жә не технологиялық шараларды іске асырып, мең геру жұ мыс салаларында ө те қ ажет. Жер қ ойнауындағ ы мұ най кө лемінің жер бетіне шығ арғ андағ ы кө лемінің қ атынасын мұ найдың кө лемдік коэффициенті деп атаймыз. Ол былай жазылады:
В= V қ аб. (1. 3)
V жер. б
Vқ аб. - мұ найдың қ абат бойындағ ы кө лемі.
В= 100 м2
90 м2 (1. 4)
Vжер. б-мұ найды жер бетіне шығ арғ андағ ы кө лемі.
Газдан айырылғ ан мұ найдың кө лемін есептегенде қ арапайым атмосфералық қ ысымда Р0 (0, 1 МПа) жә не Т0=20 0С 293 К температурада анық талады. Газдан айырылғ ан мұ найдың тығ ыздығ ы бірнеше шамада ө згереді. (600-1000) жә не де одан да кө пт болуы мү мкін. Қ абатта мұ найдың тығ ыздығ ы температурағ а жә не еріген газдың кө леміне байланысты ө згереді. Қ ысым ұ лғ айғ ан сайын мұ найдың тығ ыздығ ы да кө бейеді, ал температурамен еріген газдың кө лемі кө белген сайын тығ ыздық мә ні азаяды.
Газ [1](фр. gas, гр. chaos – бей-берекет) — заттың атомдары мен молекулалары бір-бірімен ә лсіз байланысқ андық тан, кез келген бағ ытта еркін қ озғ алатын жә не ө зіне берілген кө лемге толық жайылып орналасатын агрегаттық кү йі. «Газ» атауын ғ ылыми қ олданысқ а 17 ғ асырдың басында голланд ғ алымы Ян Баптист ван Гельмонт енгізген. Газ молекулаларының соқ тығ ысу уақ ыты олардың еркін жолғ а кететін уақ ытынан ә лдеқ айда аз болады. Химиялық элементтердің ө те кіші бө лшекке бө лініп, бейтарап ұ шуы. Негізгі тұ рмыстағ ы газдар пропан, бутан, неон жә не тағ ыда басқ а Газ қ атты дене мен сұ йық тық тә різді еркін бет тү збейді жә не ол берілген кө лемді толық толтырып тұ рады. Газ тә різді кү й – заттардың (жұ лдызаралық заттар, тұ мандық тар, жұ лдыздар, планеталардың атмосферасы, тағ ыда басқ а) ғ аламдағ ы ең кө п таралғ ан кү йі. Химиялық қ асиеттері бойынша газдар жә не олардың қ оспалары (активтілігі аз инертті газдар мен қ опарылғ ыш газдар қ оспасына дейін) сан алуан болып келеді. Газғ а атомдар мен молекулалардан тұ ратын жү йе ғ ана емес, кейде басқ а бө лшектерден – фотондардан, электрондардан, броундық бө лшектерден, сондай-ақ плазмадан тұ ратын жү йелер де жатқ ызылады.
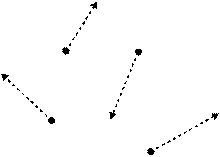
Газ кү йінің бө лшектері (атомдар, молекулалар, жә не иондар) электр ө рісі жоқ кездегі еркін қ озғ алысы.
Нақ ты (реал) газдар. Газдың тығ ыздығ ы артқ ан сайын оның қ асиеттері идеал газ кү йінен ауытқ и бастайды. Бұ л жағ дайда соқ тығ ысулардың рө лі артып, молекулалардың мө лшерлері мен олардың ө зара ә серлерін ескермеуге болмай қ алады. Мұ ндай газды нақ ты (реал) газ деп атайды.

Газ алмасу, биологияда – ағ за мен оны қ оршағ ан орта арасындағ ы газ алмасу процесі. Адам мен жануарлар ағ засы тыныс алу кезінде сыртқ ы ортадан оттекті сің іріп, ө зінен кө мі қ ышқ ыл газын жә не зат алмасу нә тижесінде пайда болатын ә р тү рлі газ қ оспаларын сыртқ а шығ арады. Газ алмасусыз тірі ағ зада зат жә не энергия алмасуы дұ рыс жү рмейді. Зат алмасу процесінің нә тижесінде ағ за сің ірген қ оректік заттардың (белок, кө мірсу, май) қ ұ рамындағ ы химиялық энергия бө лініп, ағ заның тіршілік ә рекетіне қ ажетті энергияғ а (мысалы, 1 литр оттек 4, 7 – 5, 0 ккал жылу береді) айналады. Организм пайдаланатын оттек пен одан бө лініп шығ атын кө мір қ ышқ ыл газдың мө лшері адамның жасына, тіршілік ә рекетіне, атқ аратын қ ызметіне, сыртқ ы ортаның температурасына жә не тағ амның қ ұ рамына байланысты ө згеріп тұ рады. Адам жұ мыс істегенде, ауа райы салқ ындағ анда, калориялы тамақ ішкенде ағ задағ ы газ алмасу кү шейе тү седі. Демалыс кезінде, ұ йық тағ анда газ алмасу тө мендейді. Газ алмасу арқ ылы ағ задағ ы энергия мө лшерін анық тауғ а болады. Газ алмасу процесі кезінде ағ за оттекті кө п мө лшерде пайдаланса, барлық дене мү шелерінің қ ызметі артып, тыныс алу жә не қ ан айналысы жақ сарады, осығ ан байланысты қ анның физикалық -химиялық қ ұ рамы да ө згереді. Газ алмасу бір клеткалы қ арапайымдыларда, олардың бү тіндей денесі арқ ылы, кө п клеткалы жануарларда арнаулы тыныс мү шелері (кең ірдек, желбезек, ө кпе) арқ ылы жү реді. Ө сімдіктердегі газ алмасу жануарлар мен адам ағ засындағ ыдан ө згеше болады. Тірі азғ алар сияқ ты ө сімдіктер де барлық мү шелері арқ ылы тыныс алады, тыныс алу процесі ө сімдіктің ө сіп келе жатқ ан жас мү шелері мен тіндерінде, ә сіресе, жапырақ тарында кү шті, ал сабағ ы мен тамырында баяу жү реді. Ө сімдіктер тыныс алғ ан кезде, керісінше, ауадан кө мір қ ышқ ыл газ сің іріліп, оттек бө лінеді. Химиялық заттардың кейбіреулері газ кү йінде болады, мысалы, Н2, O2, N2, Сl2, т. б. Бұ лардан басқ а кү рделі заттар да газ кү йінде бола алады: СO2, SO2, СН4, HCl, H2S, т. б. Газ кү йіндегі заттар газ заң дарына бағ ынатыны белгілі, оларды сендер физика курсынан білесің дер.
Газдардың кү йін сипаттайтын шамалар: қ ысым, кө лем, температура. Газдарды сипаттағ анда кө бінесе қ ысым мен температураны тұ рақ ты етіп алып, кө лемнің ө згерістерін қ арастырамыз, кө лемнің ө згерісі газдар ү шін дең гейлес болады, себебі олардың молекулааралық қ ашық тық тары шамамен бірдей.
Физика курсынан тығ ыздық дегеніміз газдың кө лем бірлігінің массасы екендігін білесің дер:
{\displaystyle \rho ={\frac {m}{V}}; }  г/л бұ дан {\displaystyle \nu ={\frac {m}{M}}}
г/л бұ дан {\displaystyle \nu ={\frac {m}{M}}} 
Біз осығ ан дейін қ арастырғ ан газдардың тығ ыздық тары бойынша олардың 1 молінің алатын кө лемін есептейік:
| Газ | H2 | O2 | N2 | O3 | CO2 |
{\displaystyle \rho }  , г/л , г/л
| 0, 089 | 1, 43 | 1, 25 | 2, 143 | 1, 946 |
| M, г/моль | |||||
| m, г | |||||
| N, молекула | 6, 02•1023 | 6, 02•1023 | 6, 02•1023 | 6, 02•1023 | 6, 02•1023 |
Енді осы газдардың 1 молінің кө лемдерін тапсақ:
{\displaystyle V(H_{2})={\frac {2}{0, 089}}=22, 47}  л;
л;
{\displaystyle V(O_{2})={\frac {32}{1, 43}}=22, 37}  л;
л;
{\displaystyle V(N_{2})={\frac {28}{1, 25}}=22, 4}  л;
л;
{\displaystyle V(O_{3})={\frac {48}{2, 143}}=22, 39}  л;
л;
{\displaystyle V(CO_{2})={\frac {44}{1, 964}}=22, 4}  л;
л;
{\displaystyle V_{m}=22, 4}  л/моль.
л/моль.
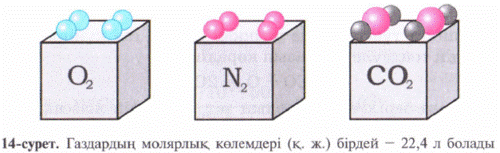
Осы есептеулерден кө рініп тұ рғ андай 1 моль газдың кө лемі шамамен бірдей екен, оның сандық мә ні 22, 4 л. Мольдік кө лем (Vm) t0С = 00С, р = 1 атм = 101, 3 кПа жағ дайында анық талғ ан, бұ л қ алыпты жағ дай (қ. ж. ) деп аталады (14-сурет).
{\displaystyle V_{m}={\frac {V}{\nu }}}  => {\displaystyle \nu ={\frac {V}{V_{m}}}}
=> {\displaystyle \nu ={\frac {V}{V_{m}}}}  ; ендеше {\displaystyle \nu ={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m}}}}
; ендеше {\displaystyle \nu ={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m}}}} 
Бірдей жағ дайда алынғ ан газдардың тең кө лемдерінде молекула сандары бірдей болады. Бұ л - Авогадро заң ы. Ол 1811 жылы ашылғ ан.
Химияда тығ ыздық тан басқ а салыстырмалы тығ ыздық деген тү сінік те пайдаланылады.
Бірдей жағ дайда тең кө лемде алынғ ан ғ аздардың массаларының қ атынасын салыстырмалы тығ ыздық деп атайды.
{\displaystyle D={\frac {m(1)}{m(2)}}={\frac {M(1)}{M(2)}}} 
Бір газдың екінші газбен салыстырғ андағ ы тығ ыздығ ы олардың молярлық массаларының қ атынасындай болады. Салыстырмалы тығ ыздық сутегі мен ауа бойынша беріледі.
Сонда
{\displaystyle D_{H_{2}}={\frac {M(x)}{M(H_{2})}}} 
{\displaystyle D_{aya}={\frac {M(x)}{aya}}} 
М(Н2) = 2 г/моль;
М(ауа) = 29 г/моль
М{х) = 2D(H2); М(х) = 29D(aya), мұ ндағ ы х - белгісіз газдың мольдік массасы.
Қ алыпты жағ дайдағ ы газдың тығ ыздығ ы мына формуламен анық талады:
{\displaystyle \rho ={\frac {M}{V_{m}}}}  (г/л)[2]
(г/л)[2]
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|