
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тиосульфат натрия
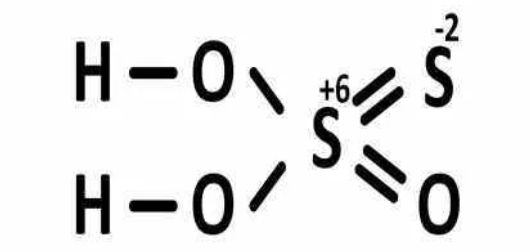

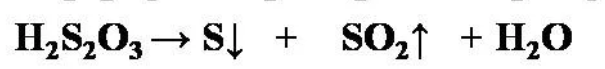
Получение:
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Na2S2O3+ Н2SО4→ Nа2SО4+SО2 + S + H2O
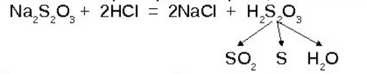
Устойчивыми являются соли: тиосульфаты или гипосульфиты. Наибольшее значение имеет тиосульфат натрия (гипосульфит натрия, серноватистокислый натрий, «антихлор»). Антихлор - вещество (гипосульфит), поглощающее хлор, применяется главнымобразом при белении тканей и дляудаления остатков хлора из воды, подвергшейся хлорированию.
Получение:
1. Кипячение избытка серы с сульфитом натрия:
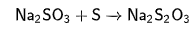
2. Кипячение избытка серы с гидроксидом натрия:

2S +6ОН- -4е-→ S2O32- +3Н2О
S + 2е-→ S2-
2S +6 ОН- + 2S → S2O32- +2S2- +3Н2О
3. Взаимодействием H2S и SO2 с NaOH
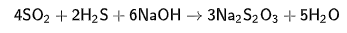
2SО2 +Н2О -4е-→ S2O32- +2ОН-
2Н2S + 10 ОН- +8е-→ S2O32- +7 Н2О
4SО2 +2Н2О+ 2Н2S + 10 ОН-→ 2 S2O32- +4ОН- + S2O32- +7 Н2О
Химические свойства тиосульфата натрия:
1. При белении хлором волокна бумаги и тканей даже после тщательного промывания упорно удерживают хлор, который мало-помалу их разрушает. Поэтому Nа2S2О3 как «антихлор»( а восстановительными свойствами обладает атома серы в степени окисления -2) применяют для связывания остатков активного хлора, остающегося на волокне. Cl2переходит в безвредный хлорид-ион. Причем в зависимости от условий могут быть разные продукты (но хлороводород как один из продуктов будет всегда). При недостатке окислителя S2- окисляется до S; при избытке-до SО42-
Cl2 + Na2S2O3 + Н2О = Na2SO4 + S + 2HCl
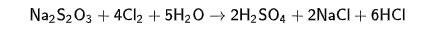
Nа2S2О3 +4Сl2 + 5Н2О→ 2NаНSО4 + 8НСl
Марлевые повязки, пропитанные раствором тиосульфатом натрия, использовали для защиты органов дыхания от отравляющего вещества хлора в Первую мировую войну.
2. Тиосульфат натрия широко используют в аналитической химии, поскольку он является реактивом в иодометрии. 
Таким образом можно определить концентрацию окислителей. 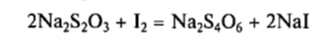 тетратионат натрия
тетратионат натрия
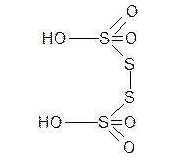 тетратионовая кислота.
тетратионовая кислота.
3. Качественные реакции на тиосульфат:
Реакция с раствором серебра нитрата.
При добавлении избытка нитрата серебра выделяется белый осадок, который быстро желтеет, при стоянии он буреет и, наконец, чернеет за счет образования сульфида серебра
Сначала образуется белый осадок серебра тиосульфата:
Na2S2O3 + 2AgN03 → Ag2S2O3 ↓ + 2NaN03
Серебра тиосульфат быстро разлагается (внутримолекулярная окислительно-восстановительная реакция), образуются серебра сульфит и сера (желтый осадок):
Ag2S2O3 → Ag2SO3↓ + S↓
При стоянии образуется черный осадок серебра сульфида:
Ag2SO3 + S + H2O → Ag2S↓ + H2SO4
Если методику проведения реакции изменить – добавлять тиосульфат натрия к раствору нитрата серебра, то белый осадок тиосульфата серебра растворяется в избытке тиосульфата натрия:
Ag2S2O3 + 3Na2S2O3 → 2Na3[Ag(S2O3)2]

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|