
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гидроксилирование лизинового остатка



Фосфорилирование белков представляет собой наиболее распространенную форму их регуляторной посттрансляционной модификации. Оно происходит у всех организмов, и показано, что примерно 1/3 всех белков в клетке млекопитающих в определенные моменты времени подвергается фосфорилированию.
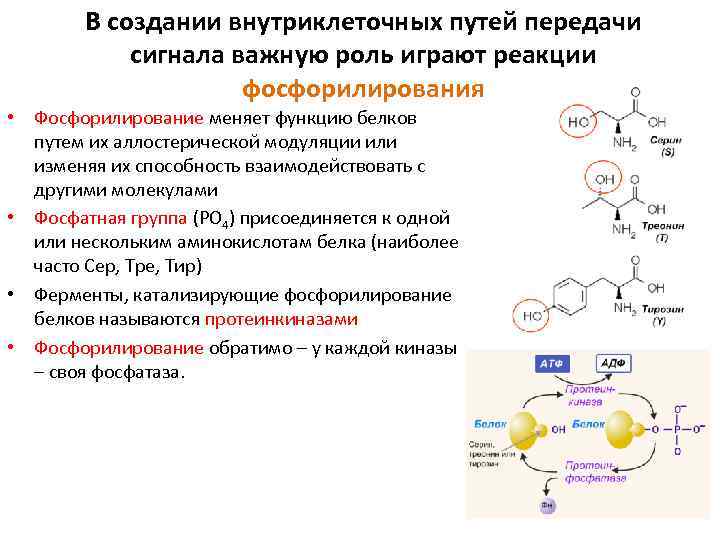
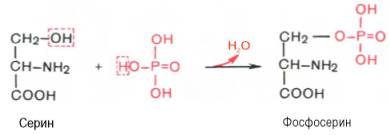
Фосфорилирование может стимулировать или ингибировать каталитическую активность ферментов, сродство, с которым белок связывается с другими молекулами, его внутриклеточную локализацию и способность к дальнейшим ковалентным модификациям, или изменять его стабильность. При фосфорилировании одного остатка активность белка может измениться в 500 и более раз, и часто белки фосфорилируются по нескольким сайтам сложными и взаимозависимыми путями. Большинство белков клеток эукариот и практически все в клетках животных фосфорилируются с участием протеинкиназ; их дефосфорилирование катализируется фосфопротеинфосфатазами. Оба класса ферментов находятся под контролем различных механизмов. Протеинкиназы переносят фосфатную группу с АТФ на остатки Ser, Thr и Tyr в белковых субстратах, образуя химически устойчивые фосфорные эфиры.
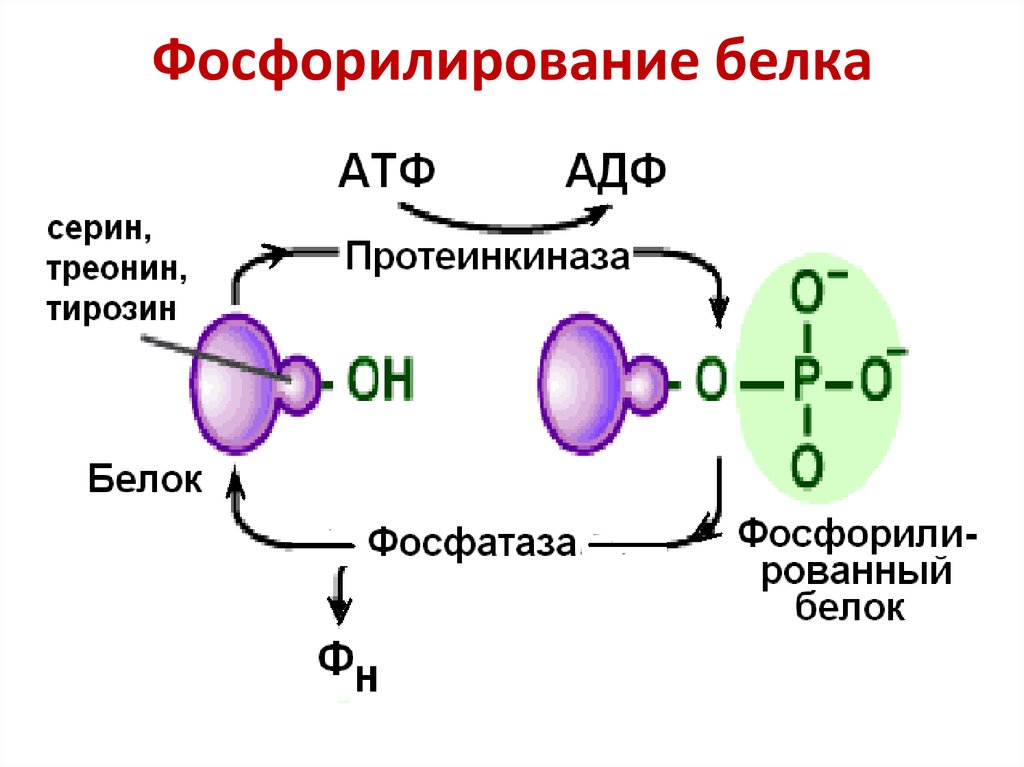
Часто, наряду с этим, белки фосфорилируются несколькими протеинкиназами, что приводит к возникновению фосфорилированных форм, обладающих различной активностью. Это позволяет интегрироваться различным входным сигналам, обеспечивая активацию белков-мишеней.
У бактерий, растений и грибов важную роль играет еще одна система фосфорилирования белков, которая называется двухкомпонентной сигнальной системой. Участвующие в этой системе протеинкиназы отличаются от соответствующих ферментов эукариот и фосфорилируют остатки аспарагиновой кислоты, а не серина, треонина или тирозина.
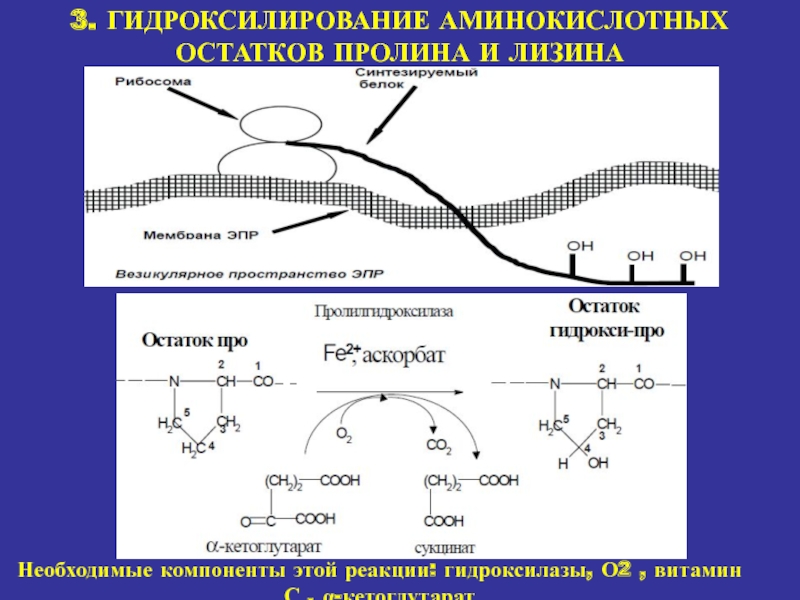
Гидроксилирование Pro стабилизирует тройную спираль. Эту реакцию катализирует пролилгидроксилаза - фермент, связанный с шероховатым эндоплазматическим ретикулумом. Фермент, выделенный из куриных эмбрионов, имеет мол. массу 230 000. Он представляет собой тетрамер, состоящий из мономерных субъединиц двух типов - с мол. массой 60000 и 64000. Мономер неактивен. Молекула фермента имеет сильно выраженные кислотные свойства, ее pI=4, 4. Пролингидроксилаза катализирует превращения только пептидилпролина, по отношению к свободному пролину она неактивна. Этот фермент является оксигеназой со смешанными функциями. Для его активирования требуются молекулярный кислород, Fe2+, α -кетоглутаровая и аскорбиновая кислоты. Одновременно с гидроксилированием пролина α -кетоглутаровая кислота окислительно декарбоксилируется с образованием сукцината. При этом выделяется CO2, количество которого измеряют при определении активности фермента. Кислород расходуется в реакции прямого замещения в положении С-4 пролинового остатка. Субстраты связываются с ферментом в следующем порядке: Fe2+, α -кетоглутаровая кислота, кислород, полипептид. Гидроксилирование происходит только после того, как все четыре субстрата связались с ферментом. Продукты удаляются в следующем порядке: гидроксилированный пептид, CO2, сукцинат. Аскорбат не расходуется стехиометрически. Он ассоциирует с ферментом либо до связывания железа, либо после удаления одного или двух продуктов. In vitro несколько пролиновых остатков гидроксилируются в отсутствие аскорбата. По-видимому, аскорбат не является необходимым для гидроксилирования. Он требуется для регенерации железа в восстановленной форме. При недостатке аскорбиновой кислоты цепи коллагена гидроксилируются не полностью.
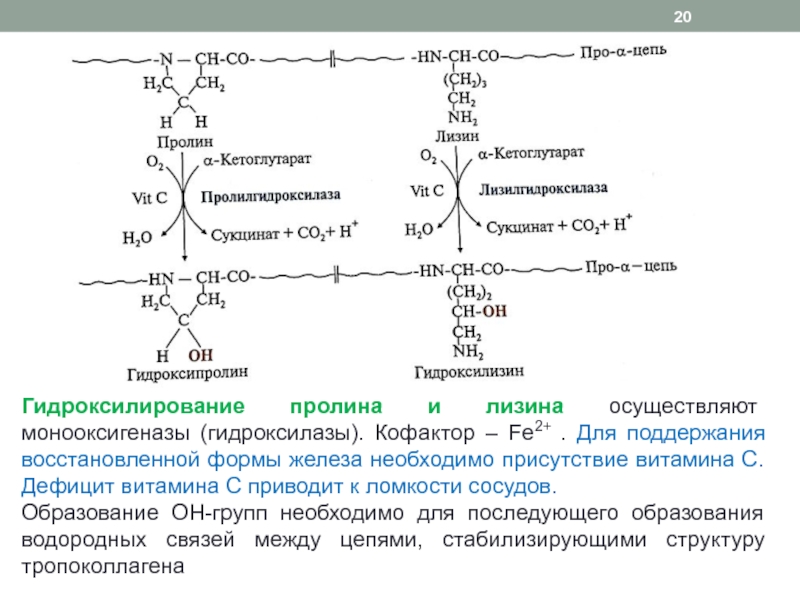
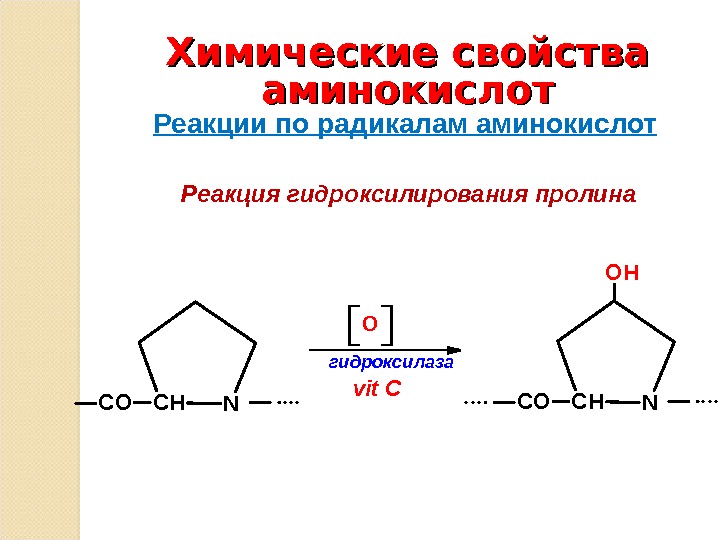
Гидроксилирование лизинового остатка
Лизин включается в про-α -цепи в ходе трансляции. Его гидроксилирование катализируется лизилгидроксилазой. Фермент, выделенный из куриных эмбрионов, имеет мол. массу 550000 и 200000. Как и для пролилгидроксилазы, для его активации необходимы молекулярный кислород, α -кетоглутаровая кислота, Fe2+ и аскорбиновая кислота. Обе гидроксилазы имеют близкие значения КМ. Они обратимо ингибируются n-хлормеркурибензоатом (nХМВ), что указывает на участие в катализе SH-групп фермента. Дитиотрейтол увеличивает активность обеих гидроксилаз. Как и гидроксилирование пролина, гидроксилирование лизиновых остатков происходит до образования тройной спирали. Содержание гидроксилизина (Hyl) различно в коллагене разных типов и с возрастом увеличивается. При недостатке витамина D содержание Hyl в коллагене растет.
Карбоксилированием называют введение в молекулу органического соединения карбоксильной группы. Таким образом получают, например,
γ -карбоксиглутаминовую кислоту:

γ -Карбоксиглутаминовая кислота входит в состав белков, участвующих в процессах свертывания крови, так как две близлежащие карбоксильные группы в её структуре способствуют более полному связыванию белковых факторов с ионами кальция:
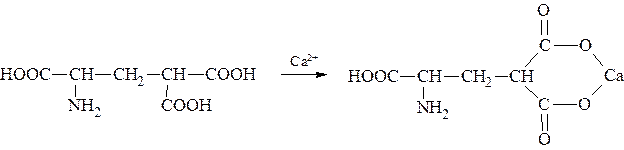
Нарушение карбоксилирования глутамата приводит к снижению свертываемости крови.



Гликозилирование (англ. Glycosylation) — присоединение остатков сахаровк органическим молекулам и образование гликозидов, или, в случае белков и липидов, гликопротеиды и
гликолипиды, соответственно. Преобладающая часть белков, синтезируемых в шероховатом эндоплазматическом ретикулюме, подвергается гликозилированию. В цитоплазме и ядре гликозилирование осуществляется в форме O-GlcNAc модификации. Известны пять классов гликанов: в случае N-связанных гликанов сахар присоединен к атому азота боковой цепи остатка аспарагина или аргинина; в Oсвязанных гликанах сахар присоединен к гидроксилам боковых цепей остатков серина, треонина, тирозина или гидроксилизина или к атомам кислорода липидов, например, церамидов; фосфогликаны содержат остаток сахара, соединенный через фосфат с серином; C-связанные гликаны представляют собой редкую форму гликозилирования, в которой сахар соединяется с атомом углерода боковой цепи триптофана
Функциональное значение гликозилирования
Стабилизация структуры белков, защита от протеаз (особеннодля секреторных белков). Передача сигнала– клеточные рецепторы в основном –гликопротеины и протеогликаны.


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|