
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Конспект урока Насыщенный пар
Все мы отлично знаем, что жидкости со временем испаряются. Например, после дождя лужи достаточно быстро высыхают. Если оставить на столе стакан воды, то через достаточно долгое время вода тоже испарится. Таких примеров можно привести много. Как вы, наверное, заметили, жидкости испаряются быстрее при более высокой температуре. Давайте попытаемся объяснить эти явления, основываясь на том, что мы уже знаем из молекулярной физики. Вспомним, что молекулы жидкости движутся беспорядочно. Как мы недавно убедились, чем больше температура, тем больше средняя кинетическая энергия молекул. Разумеется, в жидкости есть молекулы, кинетическая энергия которых меньше, чем среднее значение и есть молекулы, кинетическая энергия которых больше, чем среднее значение. Так вот, кинетическая энергия наиболее быстрых молекул может стать достаточно большой, для того, чтобы вылететь из жидкости, преодолев силы притяжения остальных молекул. Этот процесс называется испарением.
Как только молекула вылетела из жидкости, она стала частью газа, молекулы которого тоже беспорядочно двигаются. Таким образом, эта молекула может навсегда удалиться от поверхности жидкости, а может, наоборот, вернуться обратно. Этот процесс называется конденсацией.
При испарении, число молекул, вылетевших из жидкости, превышает число вернувшихся молекул. То есть, постепенно количество пара увеличивается, а количество жидкости постепенно уменьшается. Это и означает, что жидкость превращается в пар. Заметим, что если образовавшиеся пары жидкости уносят потоки воздуха, то жидкость будет испаряться быстрее, поскольку у молекул не будет возможности вернуться обратно в жидкость. Это подтверждается и бытовыми наблюдениями: например, бельё на ветру сохнет быстрее, чем в безветренную погоду. Заметим также, что чем выше температура, тем быстрее происходит испарение. Это объясняется тем, что при более высокой температуре большее число молекул имеет достаточную кинетическую энергию, чтобы покинуть жидкость. Это тоже подтверждается бытовыми наблюдениями: вы с уверенностью можете сказать, что в жаркий летний день лужа высохнет быстрее, чем прохладным осенним днем.
Заметим, что при испарении жидкость теряет свои самые быстрые молекулы, поэтому, средняя кинетическая энергия молекул жидкости уменьшается. Это означает, что температура жидкости при испарении уменьшается.
Рассмотрим теперь, что происходит в закрытом сосуде при постоянной температуре. Сначала жидкость начнет испаряться, но, спустя некоторое время, пар начнет конденсироваться. Поскольку объём сосуда остаётся неизменным, чем больше молекул покидает жидкость, тем больше становится плотность пара в сосуде. Но, вместе с этим, все больше молекул имеют шанс вернуться обратно в жидкость. При неизменной температуре в сосуде, в конце концов, количество молекул, покидающих жидкость, станет равно количеству молекул, возвращающихся обратно. Такое состояние называется динамическим равновесием.

Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром. То есть, если пар является насыщенным, то в данном объёме, при данной температуре не может находиться большее количество пара.
Если сжать насыщенный пар при постоянной температуре, то динамическое равновесие нарушиться. Количество молекул, переходящих из газа в жидкость будет превышать количество молекул, переходящих из жидкости в газ до тех пор, пока в сосуде снова не установится динамическое равновесие. Обратите внимание на несколько важных пунктов: из определения насыщенного пара следует, что его плотность строго определена для данной жидкости. Поэтому, концентрация насыщенного пара остается постоянной при динамическом равновесии, независимо от объёма.
А теперь, вспомним связь между давлением, концентрацией и температурой:
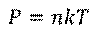
Мы только что выяснили, что концентрация остается постоянной, и мы рассматривали процесс при постоянной температуре. Поскольку коэффициент k — это постоянная Больцмана, которая является константой, делаем вывод, что давление насыщенного пара не зависит от занимаемого им объёма.
На первый взгляд может показаться, что это противоречит одному из газовых законов: при постоянной температуре давление остается постоянным, несмотря на то, что объём уменьшается. Никакого противоречия здесь нет: дело в том, что газовые законы применимы к газу постоянной массы, а масса насыщенного пара меняется при сжатии, поскольку часть его молекул переходит в жидкость. Тем не менее, состояние насыщенного пара достаточно точно описывается уравнением Менделеева-КлапейрОна, хотя насыщенный пар, строго говоря, не является идеальным газом.
Не трудно догадаться, что ненасыщенный пар — это пар, который не находится в динамическом равновесии со своей жидкостью. Или ненасыщенным паром можно называть такой пар, который при сжатии при постоянной температуре не превращается в жидкость. Тем не менее, если продолжать сжимать пар, то в какой-то момент, он все же станет насыщенным, и начнет превращаться в жидкость при дальнейшем сжатии. Следует отметить, что пар превращается в жидкость не при любой температуре, а только если температура ниже определённого значения. Такая температура называется критической.
Итак, если температура вещества выше критической, то его состояние называют газом.
Если же температура ниже критической, но вещество находится в газообразном состоянии, то такое состояние называется паром.
Например, критическая температура воды равна 647 К или 374 оС.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|