
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа «Определение общей жесткости воды»
Выполнила: студентка группы 0482
Юдакова А. С.
Цель работы. Определить общую жесткость природной или водопроводной воды титрованием рабочим раствором трилона Б.
Жесткость воды зависит от присутствия в ней растворимых солей магния, кальция (чаще всего гидрокарбонатов, сульфатов, хлоридов и др. ).
Различают: 1) временную (устранимую) карбонатную жесткость, обусловленную наличием в растворе гидрокарбонатов: Ca(HCO3)2, Mg(HCO3)2;
2) постоянную жесткость, обусловленную присутствием в растворе сульфатов, хлоридов кальция и магния;
3) общую жесткость, которая равна сумме временной и постоянной.
Жесткость воды измеряется в мэкв/л.
Для характеристики природных вод по их степени жесткости принята следующая классификация:
1. Очень мягкая, если жесткость < 1, 5 мэкв/л;
2. Мягкая, если жесткость равна 1, 5 – 3, 0 мэкв/л;
3. Умеренно-жесткая, если жесткость равна 3, 0-6, 0 мэкв/л;
4. Жесткая, если жесткость равна 6, 0-9, 0 мэкв/л;
5. Очень жесткая вода, если жесткость более 9, 0 мэкв/л.
Выполнение работы . В коническую колбу емкостью 200-250 мл пипеткой отбирают 50, 0 мл исследуемой воды. Добавляют мерным цилиндром 5 мл аммиачной буферной смеси, вносят сухую смесь эриохрома черного с NaCl (раствор должен иметь винно-красный цвет) и титруют рабочим раствором трилона Б до появления синей окраски от одной капли титранта. Титрование повторяют до 3-х воспроизводимых результатов.
| CH(ЭДТА) = 0, 056 моль экв/л Vа(H2O) = 50, 0 мл V1(ЭДТА) = 2, 5 мл V2(ЭДТА) = 2, 6 мл V3(ЭДТА) = 2, 6 мл | 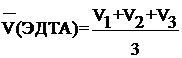 = = 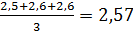 (мл) (мл)
 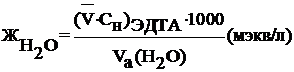
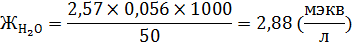
|
Вывод: в ходе проделанной лабораторной работы была определена общая жесткость воды комплексонометрическим титрованием пробы с помощью трилона Б.


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|