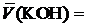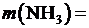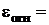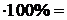- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Отчёт о работе
| Работу выполнил: | |
| фамилия | Юдакова |
| имя | Арина |
| отчество | Сергеевна |
| группа | |
Цель работы
Освоить методику выполнения титриметрического анализа, определить массовую долю аммиака в соли аммония методом заместительного титрования.
Задание
1. Ознакомиться со способами титрования в методе титриметрии.
2. Привести теоретическое обоснование для выполнения работы.
3. Ознакомиться с инструкцией по выполнению лабораторной работы. Выполнить работу согласно инструкции.
4. Внести начальные данные в таблицу 1.
5. Результаты измерений скопировать и занести в таблицу 2.
6. Используя уравнения 1 − 4, рассчитать соответственно среднее значение объёма израсходованного титранта ( 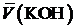 , [мл]), массу хлорида аммония (m, [г ]), массовую долю аммиака
, [мл]), массу хлорида аммония (m, [г ]), массовую долю аммиака 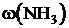 , %, относительную погрешность результата определения (ε отн, [%]). Результаты расчётов занести в таблицу 2.
, %, относительную погрешность результата определения (ε отн, [%]). Результаты расчётов занести в таблицу 2.
7. Ответить на контрольные вопросы.
Теоретическое обоснование
| С помощью кислотно-основного титрования можно определять содержание аммиака в солях аммония. Поскольку непосредственно титровать соль аммония щелочью нельзя из-за отсутствия скачка рН на кривой титрования, приходится применять метод обратного титрования или метод замещения. Более простым и достаточно точным является метод заместительного титрования. Он заключается в том, что к раствору соли аммония прибавляют раствор формальдегида CH2O (формалин), реагирующий с солью аммония, например с NH4Cl: 4NH4Cl + 6CH2O = (CH2)6N4 + 4HCl + 6H2O. Так как количество образующейся в реакции HCl эквивалентно взятому количеству NH4Cl, то оттитровав HCl раствором NaOH, можно рассчитать исходное количество (г) NH4Cl, а следовательно, и NH3 в навеске и вычислить массовую долю (%) NH3 в соли аммония. |
Расчётные формулы
Среднее арифметическое объёма израсходованного титранта:
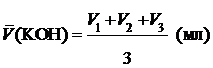 , (1)
, (1)
где 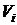 — результаты параллельных определений, [мл].
— результаты параллельных определений, [мл].
Содержание (масса) хлорида аммония в анализируемом растворе:
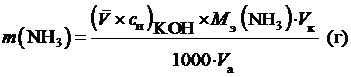 , (2)
, (2)
где 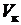 — объём мерной колбы, [мл],
— объём мерной колбы, [мл], 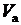 — объём аликвоты раствора хлорида аммония, [мл].
— объём аликвоты раствора хлорида аммония, [мл].
Массовая доля аммиака в хлориде аммония:
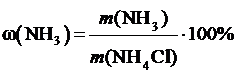 . (3)
. (3)
Относительная погрешность определения:
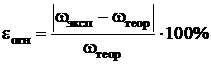 , (4)
, (4)
где 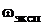 — экспериментально полученное значение массовой доли аммиака, [%].
— экспериментально полученное значение массовой доли аммиака, [%].
Начальные данные
Таблица 1
| № варианта | 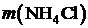 , г , г
| 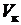 , мл , мл
| 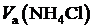 , мл , мл
| 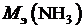 , [г/моль экв] , [г/моль экв]
| 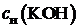 , [моль экв/л] , [моль экв/л]
| 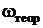 , % , %
|
| 0, 537 | 0, 0990 | 31, 78 |
Результаты
Таблица 2
| № п. п. | 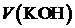 , [мл] , [мл]
| 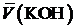 , [мл] , [мл]
| 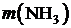 , [г] , [г]
| 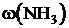 , % , %
| ε отн, [%] |
| 10, 40 | 10, 37 | 0, 1745 | 32, 5 | 2, 27 | |
| 10, 40 | |||||
| 10, 30 |
|
| 10, 40 | + | 10, 40 | + | 10, 30 | = | 10, 37 | (мл) |
|
| 1, 0267 | 
| 
| = | 0, 1745 | (г) | ||
|
| |32, 5 | – | |31, 78 |
| 2, 27% |
| 31, 78 | |||||
Вывод
(в соответствии с целью работы)
| В ходе проделанной работы мы освоили методику выполнения титриметрического анализа, определили массовую долю аммиака в соли аммония методом заместительного титрования, результат составил 32, 5% с относительной погрешностью 2, 27%. |
Контрольные вопросы
(ответьте на 3 вопроса по Вашему выбору)
| 1. Почему для определения солей аммония не пригоден метод прямого титрования? |
| Т. к. при титровании солей аммония щелочью на кривой титрования отсутствует скачок рН. |
| 2. Какая реакция лежит в основе косвенного определения солей аммония? |
| Добавление к соли аммония раствора формалина, который при реакции с солью образует кислоту: 4NH4Cl + 6CH2O = (CH2)6N4 + 4HCl + 6H2O. |
| 3. Какой титрант используется при определении соли аммония? |
| Щелочь, NaOH или KOH |
| 4. Каким стандартом (первичным или вторичным) является титрант? |
| 5. Назовите установочные вещества для титранта, используемого при определении солей аммония |
| 6. Какое вещество является заместителем при косвенном определении соли аммония? |
| 7. По какому типу протекает гидролиз солей аммония? |
| 8. Как рассчитать рН раствора в любой момент до точки эквивалентности при косвенном определении соли аммония? |
| 9. Какое вещество обусловливает рН раствора в точке эквивалентности при косвенном определении соли аммония? |
| 10. Как рассчитать рН раствора в любой момент после точки эквивалентности? |
| 11. В какой области рН лежит скачок на кривой титрования при косвенном определении соли аммония? |
| 12. В какой области рН лежит скачок на кривой титрования при косвенном определении соли аммония? |
| 13. Какую окраску принимает индикатор в конце титрования? |
| Бледно-розовый |
| 14. Как повлияет на степень гидролиза соли аммония разбавление раствора, повышение температуры, добавление сильной кислоты? |
| 15. Какое значение рН имеют растворы солей аммония и почему? |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|