
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Строение .
БЕЛКИ
Белки – это сложные высокомолекулярные органические соединения, образованные из остатков α -аминокислот, соединенных пептидными (амидными) связями.
Состав белков.
В состав белков входит углерод, водород, кислород и азот. Многие белки содержат серу, некоторые – фосфор железо, цинк, медь.
Строение α -аминокислот, образующих белки можно выразить общей формулой:
  В составе радикала могут быть различные функциональные группы, R –CH – COOH открытые цепи, циклы. Это могут быть функциональные группы:
NH2 -NH2, - COOH, -SH, -OH, - C6H5
Например:
NH2 – CH2 – COOH – глицин В составе радикала могут быть различные функциональные группы, R –CH – COOH открытые цепи, циклы. Это могут быть функциональные группы:
NH2 -NH2, - COOH, -SH, -OH, - C6H5
Например:
NH2 – CH2 – COOH – глицин
 NH2 – CH – COOH – аланин
CH3 NH2 – CH – COOH – аланин
CH3
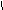 C6H5 – CH2 – CH – COOH-фенилаланин
NH2 C6H5 – CH2 – CH – COOH-фенилаланин
NH2
 НS – CH2 – CH – COOH – цистеин
NH2 НS – CH2 – CH – COOH – цистеин
NH2
 HO – CH2- CH - COOH– cерин
NH2
Молекулярные массы различных белков (полипептидов) составляют от 10 000 до нескольких миллионов. Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Несмотря на многочисленность белков, в их состав входят остатки лишь 22 a-аминокис лот. Формально образование белковой макромолекулы можно представить как реакцию поликонденсации a-аминокислот: HO – CH2- CH - COOH– cерин
NH2
Молекулярные массы различных белков (полипептидов) составляют от 10 000 до нескольких миллионов. Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Несмотря на многочисленность белков, в их состав входят остатки лишь 22 a-аминокис лот. Формально образование белковой макромолекулы можно представить как реакцию поликонденсации a-аминокислот:
Строение. Можно выделить четыре уровня строения полипептидной цепи.
Вторичная структура – закрученная в спираль полипептидная цепь. Такая конфигурация удерживается благодаря многочисленным водородным связям между
Третичная структура – спираль закрученная в клубок. Держится за счет дисульфидных мостиков– S – S -, взаимодей-ствия групп-NH2, -OH, - COOH, не участвующих в пептидной связи. Третичная структура – высшая форма пространственной ориентации белков |  . Однако некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями.
По хим. составу белки делятся на 2 группы:
1. Простые белки – протеины, образующие при гидролизе только α -аминокислоты.
2. Сложные белки – протеиды, образующие при гидролизе α - аминокислоты и небелковые вещества (углеводы, нуклеиновые кислоты)
Физические свойства: весьма разнообразны и определяются их строением. Белки делят на 2 группы: глобулярные – растворяются в воде или образуют коллоидные растворы.
фибриллярные – нерастворимые.
Химические свойства.
1. Подвергаются гидролизу в присутствии кислот и щелочей при нагревании. В природе – под действием ферментов. . Однако некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями.
По хим. составу белки делятся на 2 группы:
1. Простые белки – протеины, образующие при гидролизе только α -аминокислоты.
2. Сложные белки – протеиды, образующие при гидролизе α - аминокислоты и небелковые вещества (углеводы, нуклеиновые кислоты)
Физические свойства: весьма разнообразны и определяются их строением. Белки делят на 2 группы: глобулярные – растворяются в воде или образуют коллоидные растворы.
фибриллярные – нерастворимые.
Химические свойства.
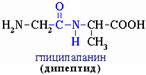
1. Подвергаются гидролизу в присутствии кислот и щелочей при нагревании. В природе – под действием ферментов.
   О H О H

  NH2 – СН2 – C – N – СН– COOH + H2O NH2 – СН2 – CООН + NH2 – СН – CООН СН3 глицин СН3 аланин
2. Денатурация – разрушение вторичной и третичной структуры белка с сохранением
первичной структуры. Необратимый процесс. Происходит под действием различных факторов: температуры, солей тяжелых металлов, яркого освещения, радиации, спирта и. т. д.
3. Качественные реакции на белки.
а) при высокой температуре разлагаются с выделением летучих веществ с запахом жженых перьев.
б) ксантопротеиновая реакция: белок + HNO3(к) → желтое окрашивание Происходит нитрование бензольных колец в радикалах остатков аминокислот. NH2 – СН2 – C – N – СН– COOH + H2O NH2 – СН2 – CООН + NH2 – СН – CООН СН3 глицин СН3 аланин
2. Денатурация – разрушение вторичной и третичной структуры белка с сохранением
первичной структуры. Необратимый процесс. Происходит под действием различных факторов: температуры, солей тяжелых металлов, яркого освещения, радиации, спирта и. т. д.
3. Качественные реакции на белки.
а) при высокой температуре разлагаются с выделением летучих веществ с запахом жженых перьев.
б) ксантопротеиновая реакция: белок + HNO3(к) → желтое окрашивание Происходит нитрование бензольных колец в радикалах остатков аминокислот.
 в) биуретовая реакция: NaOH+CuSO4 + белок → красно-фиолетовое окрашивание.
Cu(OH)2
Происходит реакция на пептидные связи в молекулах белка.
Биологические функции:
Ø Строительная – белки строительный материал клеток, из них построены опорныемышечные и покровные ткани.
Ø Энергетическая – некоторые белки распадаются до СО2 и Н2О с выделением энергии.
Ø Транспортная – осуществляют перенос веществ в организме, например гемоглобин.
Ø Двигательная – сокращения мышц выполняют сократительные белки.
Ø Сигнальная – прием сигналов из внешней среды и передача команд в клетку осуществляется белками, находящимися в поверхностной мембране клетки и способными изменять третичную структуру.
Ø Защитная – образование антител, при попадании чужеродных белков или клеток в организм.
Ø Ферментативная – белки ускоряют реакции в клетке в десятки, сотни миллионов раз. в) биуретовая реакция: NaOH+CuSO4 + белок → красно-фиолетовое окрашивание.
Cu(OH)2
Происходит реакция на пептидные связи в молекулах белка.
Биологические функции:
Ø Строительная – белки строительный материал клеток, из них построены опорныемышечные и покровные ткани.
Ø Энергетическая – некоторые белки распадаются до СО2 и Н2О с выделением энергии.
Ø Транспортная – осуществляют перенос веществ в организме, например гемоглобин.
Ø Двигательная – сокращения мышц выполняют сократительные белки.
Ø Сигнальная – прием сигналов из внешней среды и передача команд в клетку осуществляется белками, находящимися в поверхностной мембране клетки и способными изменять третичную структуру.
Ø Защитная – образование антител, при попадании чужеродных белков или клеток в организм.
Ø Ферментативная – белки ускоряют реакции в клетке в десятки, сотни миллионов раз.
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
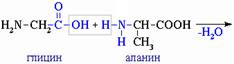
 Первичная структура – строгая последовательность аминокислотных звеньев в полипептидной цепи.
Первичная структура – строгая последовательность аминокислотных звеньев в полипептидной цепи.  Лиз │ глу │ ала │ ала │ гли │
Лиз │ глу │ ала │ ала │ гли │  группами – С=О и –N-Н расположенными на соседних витках спирали.
группами – С=О и –N-Н расположенными на соседних витках спирали.