
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
■ ECHINOCOCCOSIS + Alveolar hydatid disease (AHD)
| Cestode Infections | Цестодные инфекции | |
|
■ ECHINOCOCCOSIS + Alveolar hydatid disease (AHD) | ■ ЭХИНОКОККОЗ | |
| Echinococcosis is an infection caused in humans by the larval stage of Echinococcus granulosus(Echinococcosis) sensu lato, E. multilocularis(AHD), or E. vogeli. E. granulosus sensu lato parasites produce cystic hydatid disease, with unilocular cystic lesions. These infections are prevalent in most areas where livestock is raised in association with dogs. Molecular evidence has demonstrated that E. granulosus strains belong to a range of genotypes and more than one species. Currently, human cystic hydatid disease is caused by organisms formerly termed E. granulosus that are now classified as E. granulosus sensu stricto (genotypes 1–3), E. canadensis (genotypes 6–8 and 10), and E. ortleppi (genotype 5). Other species—E. equinus (genotype 4) and E. felidis (lion strain)—have not been identified in human infections. E. granulosus sensu lato parasites are found on all continents, with areas of high prevalence in China, central Asia, the Middle East, the Mediterranean region, eastern Africa, and parts of South America. E. multilocularis, which causes multilocular alveolar lesions that are locally invasive, is found in Alpine, sub-Arctic, or Arctic regions, including central and northern Europe; western China and central Asia; and isolated areas in North America. E. vogeli causes polycystic hydatid disease and is found only in Central and South America. | Эхинококкоз - это инфекция, вызываемая у людей личиночной стадией Echinococcus granulosus sensulato, E. multilocularis или E. vogeli. вызывают кистозный эхинококкоз с однокамерными кистозными поражениями. Эти инфекции распространены в районах, где домашний скот контактирует с собаками. Данные молекулярных исследований продемонстрировали, что штаммы E. granulosus принадлежат к ряду генотипов и более чем к одному виду. В настоящее время кистозный эхинококкоз у человека вызывается микроорганизмами, ранее называвшимися E. granulosus, которые теперь классифицируются как E. granulosus sensu stricto (генотипы 1-3), E. canadensis (генотипы 6-8 и 10) и E. ortleppi ( генотип 5). Другой вид - E. equinus (генотип 4) и E. felidis (штамм льва) - не были идентифицированы при инфекциях человека. Паразиты E. granulosus sensu lato обнаружены на всех континентах, с областями высокой распространенности в Китае, Центральной Азии, Ближнем Востоке, Средиземноморском регионе, Восточной Африке и некоторых частях Южной Америки. E. multilocularis, вызывающий многокамерные локально инвазивные альвеолярныепоражения, встречается в альпийских, субарктических или арктических регионах, включая центральную и северную Европу; западный Китай и Центральная Азия; и изолированные районы в Северной Америке. E. vogeli вызывает поликистозный эхинококкоз и встречается только в Центральной и Южной Америке. | |
| Like other cestodes, echinococcal species have both intermediate and definitive hosts. The definitive hosts are canines that pass eggs in their feces. After the ingestion of eggs, cysts develop in the intermediate hosts—sheep, cattle, humans, goats, camels, and horses for the E. granulosus complex and mice and other rodents for E. multilocularis. When a dog (E. granulosus) or fox (E. multilocularis) ingests infected meat containing cysts, the life cycle is completed | Как и другие цестоды, эхинококки имеют как промежуточных, так и основных хозяев. К числу последних относятся собаки, у которых яйца выходят с фекалиями. Цисты развиваются после проглатывания яиц промежуточными хозяевами - овцами, крупным рогатым скотом, людьми, козами, верблюдами и лошадьми, когда речь идёт о E. granulosus, а также у мышей и других грызунов при заражении E. multilocularis. Когда собака (E. granulosus) или лиса (E. multilocularis) глотает инфицированное мясо, содержащее цисты, цикл замыкается. | |
|
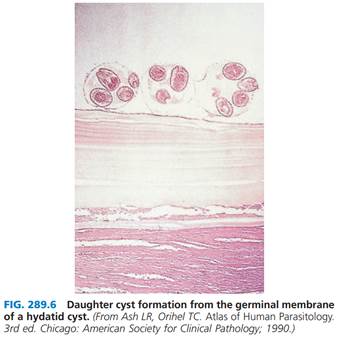
Etiology The small (5-mm-long) adult E. granulosus sensu lato worms live for 5–20 months in the jejunum of dogs. They have three proglottids: one immature, one mature, and one gravid. The gravid segment splits to release eggs that are morphologically similar to Taenia eggs and are extremely hardy. After humans ingest the eggs, embryos escape from the eggs, penetrate the intestinal mucosa, enter the portal circulation, and are carried to various organs, most commonly the liver and lungs. Larvae of E. granulosus sensu lato develop into fluid-filled unilocular hydatid cysts that consist of an external membrane and an inner germinal layer. Daughter cysts develop from the inner aspect of the germinal layer, as do germinating cystic structures called brood capsules. New larvae, called protoscolices, develop in large numbers within the brood capsule. The cysts expand slowly over a period of years | Этиология Маленькие (длиной 5 мм) взрослые черви E. granulosus sensu lato живут в тощей кишке собак 5–20 месяцев. У них три проглоттиды: одна незрелая, одна зрелая и одна беременная. Сегмент беременной расрывается, чтобы высвободить яйца, которые морфологически похожи на яйца Taenia и чрезвычайно выносливы. После того, как человек проглотил яйца, эмбрионы выходят из яиц, проникают через слизистую кишечника, попадают в портальный кровоток и переносятся в различные органы, чаще всего в печень и легкие. Личинки E. granulosus sensu lato развиваются в заполненные жидкостью однокамерные эхинококковые кисты, которые состоят из внешней оболочки и внутреннего зародышевого слоя. Дочерние кисты развиваются из внутренней части зародышевого слоя, как и прорастающие кистозные структуры, называемые выводковыми капсулами (капсулами расплода). Новые личинки, называемые протосколиками, в большом количестве развиваются внутри выводковой коробочки. Кисты медленно расширяются в течение многих лет. | |
| The life cycle of E. multilocularis is similar except that wild canines, such as foxes, serve as the definitive hosts, and small rodents serve as the intermediate hosts. The larval form of E. multilocularis, however, is quite different in that it remains in the proliferative phase, the parasite is always multilocular, and vesicles without brood capsules or protoscolices progressively invade the host tissue by peripheral extension of processes from the germinal layer. | Жизненный цикл E. multilocularis аналогичен, за исключением того, что дикие собаки, такие как лисы, служат окончательными хозяевами, а мелкие грызуны - промежуточными хозяевами. Личиночная форма E. multilocularis, однако, весьма отличается тем, что остается в пролиферативной фазе, паразит всегда многоячейковый, а везикулы без выводных капсул или протосколексов постепенно проникают в ткань хозяина за счет периферического распространения отростков из зародышевого слоя. | |
|
Clinical Manifestations Slowly enlarging echinococcal cysts generally remain asymptomatic until their expanding size or their space-occupying effect in an involved organ elicits symptoms. The liver and the lungs are the most common sites of these cysts. The liver is involved in about two-thirds of E. granulosus infections and in nearly all E. multilocularis infections. Because a period of years elapses before cysts enlarge sufficiently to cause symptoms, they may be discovered incidentally on a routine x-ray or ultrasound study. | Клинические проявления Медленно увеличивающиеся эхинококковые кисты обычно остаются бессимптомными до тех пор, пока их увеличивающийся размер или их сдавливающее воздействие на пораженный орган не вызовет симптомов. Наиболее частыми участками этих кист являются печень и легкие. Печень поражается примерно в 2/3 случаев при заражении E. granulosus и почти всегда при E. multilocularis. Поскольку проходят годы, прежде чем кисты увеличиваются в достаточной степени, чтобы вызвать симптомы, их можно случайно обнаружить при обычном рентгеновском или ультразвуковом исследовании. | |
| Patients with hepatic echinococcosis who are symptomatic most often present with abdominal pain or a palpable mass in the right upper quadrant. Compression of a bile duct or leakage of cyst fluid into the biliary tree may mimic recurrent cholelithiasis, and biliary obstruction can result in jaundice. Rupture of or episodic leakage from a hydatid cyst may produce fever, pruritus, urticaria, eosinophilia, or anaphylaxis. Pulmonary hydatid cysts may rupture into the bronchial tree or pleural cavity and produce cough, salty phlegm, dyspnea(диспноэ), chest pain, or hemoptysis. Rupture of hydatid cysts, which can occur spontaneously or at surgery, may lead to multifocal dissemination of protoscolices, which can form additional cysts. Other presentations are due to the involvement of bone (invasion of the medullary cavity with slow bone erosion producing pathologic fractures), the CNS (spaceoccupying lesions), the heart (conduction defects, pericarditis), and the pelvis (pelvic mass). | При эхинококкозе печени самыми частыми симптомами являются боль в животе и пальпируемое образование в правом подреберье. Сдавление желчного протока или анастмозирование полости кисты и желчного пузыря с дальнейшим истечением жидкости кисты в желчевыводящие пути могут имитировать рецидивирующий холелитиаз, а непроходимость желчных путей может привести к желтухе. Разрыв или эпизодическое истечение эхинококковой кисты может вызвать лихорадку, зуд, крапивницу, эозинофилию или анафилаксию. Легочные эхинококковые кисты могут прорваться в бронхиальное дерево или плевральную полость и вызвать кашель, образование соленой мокроты, одышку, боль в груди или кровохарканье. Разрыв эхинококковых кист, который может произойти спонтанно или во время операции, может привести к мультифокальному распространению протосколексов, которые могут образовывать дополнительные кисты. Другие проявления связаны с поражением костей (инвазия медуллярной полости с медленной эрозией кости, приводящей к патологическим переломам), ЦНС (синдромы сдавления), сердца (дефекты проводимости, перикардит) и таза (массивные образования). | |
| The larval forms of E. multilocularis characteristically present as a slowly growing hepatic tumor, with progressive destruction of the liver and extension into vital structures. Patients commonly report upper-quadrant and epigastric pain. Liver enlargement(← → ) and obstructive jaundice may be apparent. The lesions may infiltrate adjoining organs (e. g., diaphragm, kidneys, or lungs) or may metastasize to the spleen, lungs, or brain. | Личиночные формы E. multilocularis обычно представляют собой медленно растущую опухоль печени с прогрессирующим разрушением печени и распространением на другие жизненно важные органы. Пациенты обычно сообщают о боли в подреберье и эпигастрии. Может наблюдаться увеличение печени и механическая желтуха. Поражения могут проникать в соседние органы (например, диафрагму, почки или легкие) или могут метастазировать в селезенку, легкие или мозг. | |
|
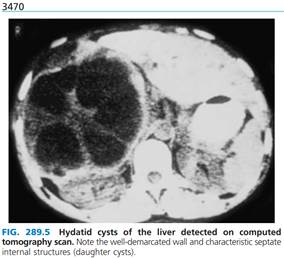
Diagnosis Radiographic and related(реле) imaging studies are important in detecting and evaluating echinococcal cysts. Plain x-rays will define pulmonary cysts of E. granulosus sensu lato—usually as rounded masses of uniform density—but may miss cysts in other organs unless there is cyst wall calcification (as occurs in the liver). MRI, CT, and ultrasound reveal well-defined cysts with thick or thin walls. Imaging methods may reveal a fluid layer of different density, termed hydatid sand, that contains protoscolices. However, the most pathognomonic finding, if demonstrable, is that of daughter cysts within the larger cyst. This finding, like eggshell or mural calcification on CT, is indicative of E. granulosus infection and helps to distinguish the cyst from carcinomas, bacterial or amebic liver abscesses, or hemangiomas. In contrast, ultrasound or CT of alveolar hydatid cysts reveals indistinct solid masses with central necrosis and plaquelike calcifications. | Диагностика Рентгенологические и другие визуализирующие исследования важны для обнаружения и оценки эхинококковых кист. Обзорный рентгеновский снимок позволяет обнаружить кисты E. granulosus sensu lato в лёгких в виде округлых образований однородной плотности, но на нём можно не увидеть кисты в других органах, если нет кальцификации стенки кисты (как это происходит в печени). МРТ, КТ и УЗИ выявляют четко очерченные кисты с толстыми или тонкими стенками. Методы визуализации могут выявить полость с жидким содержимым различной плотности, что из себя и представляет эхинококковая циста, которая содержит протосколексы. Однако наиболее патогномоничной находкой, если ее можно доказать, являются дочерние кисты внутри более крупной кисты. Эта находка, такая как яичная скорлупа или кальцификация стенок на КТ, указывает на инфекцию E. granulosus и помогает отличить кисту от карцином, бактериальных или амебных абсцессов печени или гемангиом. Напротив, УЗИ или КТ альвеолярных эхинококковых кист выявляют нечеткие твердые образования с центральным некрозом и бляшкообразными кальцификациями. | |
| A specific diagnosis of cystic hydatiddisease can be made by the examination of aspirated fluids for protoscolices or hooklets, but diagnostic aspiration is not usually recommended because of the potential risk of fluid leakage resulting in either dissemination of infection or anaphylactic reactions. Serodiagnostic assays can be useful, although a negative test does not exclude the diagnosis of echinococcosis. Cysts in the liver elicit positive antibody responses in ~90% of cases, whereas up to 50% of individuals with cysts in the lungs are seronegative. Detection of antibody to specific echinococcal antigens by immunoblotting has the highest degree of specificity. | Диагноз кистозного эхинококкоза может быть поставлен путем исследования аспирированных жидкостей на предмет протосколексов или крючков, но диагностическая аспирация обычно не рекомендуется из-за потенциального риска разрыва капсулы и излития жидкости, приводящей либо к распространению инфекции, либо к развитию анафилактического шока. Могут помочь серодиагностические анализы, хотя отрицательный результат не исключает диагноз эхинококкоза. Антитела при наличии кист в печени выявляются примерно в 90% случаев, тогда как до 50% людей с кистами в легких являются серонегативными. Выявление антител к специфическим эхинококковым антигенам методом иммуноблоттинга имеет наивысшую степень специфичности. | |
|
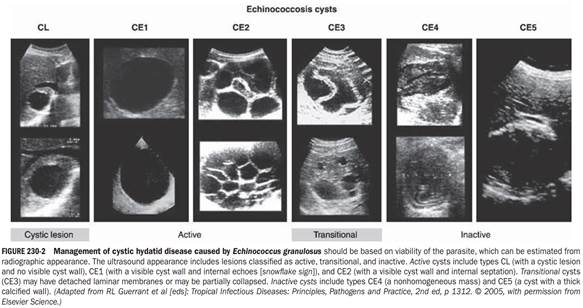
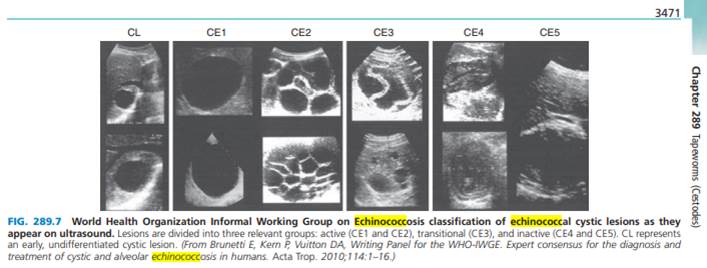
TREATMENT Echinococcosis Therapy for cystic echinococcosis is based on considerations of the size, location, and manifestations of cysts and the overall health of the patient. Surgery has traditionally been the principal definitive(diagnosis) method of treatment. Currently, ultrasound staging is recommended for cystic echinococcosis (Fig. 230-2). Small CL, CE1, and CE3 lesions may respond to chemotherapy with albendazole. For CE1 lesions and uncomplicated CE3 lesions, PAIR (Percutaneous Aspiration, Infusion of scolicidal agents, and Reaspiration) is now recommended instead of surgery. PAIR is contraindicated for superficially located cysts (because of the risk of rupture), for cysts with multiple thick internal septal divisions (honeycombing pattern), and for cysts communicating with the biliary tree. For prophylaxis of secondary peritoneal echinococcosis due to inadvertent spillage of fluid during PAIR, the administration of albendazole (15 mg/kg daily in two divided doses) should be initiated at least 2 days before the procedure and continued for at least 4 weeks afterward. Ultrasoundor CT-guided aspiration allows confirmation of the diagnosis by demonstration of protoscolices in the aspirate. After aspiration, contrast material should be injected to detect occult (оккультисты не светятся) communications with the biliary tract. Alternatively, the fluid should be checked for bile staining visually and by dipstick. If no bile is found and no communication is visualized, the contrast material is reaspirated, with subsequent (сиквел) infusion of scolicidal agents (usually 95% ethanol; alternatively, hypertonic saline). This approach, when implemented by a skilled practitioner, yields rates of cure and relapse equivalent to those following surgery, with less perioperative morbidity and shorter hospitalization. In experienced hands, some CE2 lesions can be treated by modified catheter drainage. Daughter cysts within the primary cyst may need to be punctured separately. | ЛЕЧЕНИЕ эхинококкоза При лечении кистозного эхинококкоза стоит обратить внимание на размер, месторасположение кист и симптомы, которые вызывает разрастание кисты, а также на общее состояние здоровья пациента. Хирургия традиционно была основным окончательным методом лечения. В настоящее время рекомендуется ультразвуковое исследование кистозного эхинококкоза (рис. 230-2). Небольшие поражения CL, CE1 и CE3 могут реагировать на химиотерапию альбендазолом. При поражениях CE1 и неосложненных поражениях CE3 вместо хирургического вмешательства теперь рекомендуется PAIR (чрескожная аспирация, инфузия сколицидных агентов и повторная аспирация). PAIR противопоказан для кист, расположенных на поверхности (из-за риска разрыва), для кист с множественными толстыми внутренними перегородками (сотовый узор), а также для кист, сообщающихся с билиарным деревом. Для профилактики вторичного эхинококкоза брюшины из-за непреднамеренного разлива жидкости во время ПАИР введение альбендазола (15 мг / кг в день в два приема) следует начинать не менее чемза 2 дня до процедуры и продолжать в течение не менее 4 недель после нее. Аспирация под контролем УЗИ и КТ позволяет подтвердить диагноз путем демонстрации протосколексов в аспирате. После аспирации следует ввести контрастное вещество, чтобы проверить наличие контакта с желчевыводящими путями через малозаметный свищ. В качестве альтернативы жидкость следует проверять на наличие желчи визуально и с помощью измерительного прибора. Если желчь не обнаружена и свищи не визуализируются, контрастный материал повторно аспирируется с последующей инфузией сколицидных агентов (обычно 95% этанола; в качестве альтернативы - гипертонический раствор). Этот подход, применяемый квалифицированным практикующим врачом, дает показатели излечения и рецидивов, эквивалентные таковым после операции, с меньшей периоперационной заболеваемостью и более короткой госпитализацией. В опытных руках некоторые поражения CE2 можно лечить с помощью модифицированного катетерного дренажа. Дочерние кисты внутри первичной кисты, возможно, потребуют отдельной пункции. | |
| Surgery remains the treatment of choice for complicated cystic echinococcosis (e. g., cysts communicating with the biliary tract), for most thoracic and intracranial cysts, and for areas where PAIR is not possible. For liver cysts, the preferred surgical approach is total cystectomy, in which the entire cyst and the surrounding fibrous tissue are removed. The risks posed by leakage of fluid during surgery or PAIR include anaphylaxis and dissemination of infectious protoscolices. The lattercomplication has been minimized by careful attention to the prevention of spillage of the cyst and by soaking of the drapes with hypertonic saline. Infusion of scolicidal agents is no longer recommended because of problems with hypernatremia, intoxication, or sclerosing cholangitis. Albendazole, which is active against Echinococcus, should be administered adjunctively, beginning several days before resection of the liver and continuing for several weeks for E. granulosus. Praziquantel (50 mg/kg daily for 2 weeks) may hasten the death of the protoscolices. Medical therapy with albendazole alone for 12 weeks to 6 months results in cure in ~30% of cases and in improvement in another 50%. In many instances of treatment failure, E. granulosus infections are subsequently treated successfully with PAIR or additional courses of medical therapy. Response to treatment is best assessed by serial imaging studies, with attention to cyst size and consistency. Some cysts may not demonstrate complete radiologic resolution even though no viable protoscolices are present. Some of these cysts with partial radiologic resolution (e. g., CE4 or CE5) can be managed with observation only. | Хирургическое лечение остается методом выбора при осложненном кистозном эхинококкозе (например, кисты, сообщающиеся с желчевыводящими путями), для большинства грудных и внутричерепных кист, а также для областей, где проведение PAIR невозможно. При кистах печени предпочтительным хирургическим подходом является полная цистэктомия, при которой удаляется вся киста и окружающая фиброзная ткань. Во время проведения операции или PAIR есть риск разрыва капсулы цисты и излития содержимого в грудную и/или брюшную полость, результатом чего может стать анафилаксия и распространение инфекционных протосколексов. Последнееосложнение сведено к минимуму посредством предупреждения разрыва кисты и замачивания салфеток в гипертоническим растворе NaCl с их последующим погружением в ткани (по закону осмоса гипертоническая жидкость не будет всасываться в ткани). Инфузия сколицидных средств больше не рекомендуется из-за проблем с гипернатриемией, интоксикацией или склерозирующим холангитом. Альбендазол, который активен против эхинококка, следует вводить дополнительно, начиная с нескольких дней до резекции печени и продолжая в течение нескольких недель для E. granulosus. Празиквантел (50 мг / кг в день в течение 2 недель) может ускорить наступление смерти протосколексов. Медикаментозная терапия только альбендазолом в течение от 12 недель до 6 месяцев приводит к излечению примерно в 30% случаев и к улучшению еще в 50%. Во многих случаях неудачного лечения инфекции, вызванные E. granulosus, успешно лечатся с помощью PAIR или дополнительных курсов медикаментозной терапии. Ответ на лечение лучше всего оценивать с помощью серийных визуализационных исследований, обращая внимание на размер и консистенцию кист. На рентгеновских снимках кисты могут выглядеть неизменными и неизлеченными, даже если жизнеспособные протосколики отсутствуют. Некоторые из этих кист, излечение которых на рентгене частично рассматривается (например, CE4 или CE5) можно лечить только под наблюдением. | |
| Surgical resection remains the treatment of choice for E. multilocularis infection. Complete removal of the parasite continues to offer the best chance for cure. Ongoing therapy with albendazole for at least 2 years after presumptively curative surgery is recommended. Positron emission tomography can be used to follow disease activity. Most cases are diagnosed at a stage at which complete resection is not possible; in these cases, albendazole treatment should be continued indefinitely, with careful monitoring. In some cases, liver transplantation has been used because of the size of the necessary liver resection. However, continuous immunosuppression favors the proliferation of E. multilocularis larvae and reinfection of the transplant. Thus, indefinite treatment with albendazole is required | Хирургическая резекция остается методом выбора при инфекции E. multilocularis. Полное удаление паразита по-прежнему предоставляет наибольший шанс излечения. Рекомендуется постоянная терапия альбендазолом в течение как минимум 2 лет после предположительно лечебной операции. Позитронно-эмиссионная томография может использоваться для отслеживания активности заболевания. В большинстве случаев диагноз ставится на стадии, когда полная резекция невозможна; В этих случаях лечение альбендазолом следует продолжать постоянно(пожизненно) под надзором врачей амбулаторного звена. В случаях, когда размер кисты был настолько велик, что удалялась большая часть печени, проводилась трансплантация донорской печени. Однако постоянная иммуносупрессия способствует размножению личинок E. multilocularis и повторному инфицированию трансплантата. Таким образом, требуется бессрочное лечение альбендазолом. | |
|
Prevention In endemic areas, echinococcosis can be prevented by administering praziquantel to infected dogs, by denying dogs access to viscera from infected animals, or by vaccinating sheep. Limiting the number of stray dogs is helpful in reducing(редукция) the prevalence of infection among humans. In Europe, E. multilocularis infection has been associated with gardening; gloves should be used when working with soil. | Профилактика В эндемичных районах эхинококкоз можно предупредить, вводя празиквантел больным собакам, не давая им в пищу внутренние органы инфицированных животных, а так же вакцинируя овец. Ограничение количества бездомных собак помогает снизить распространенность инфекции среди людей. В Европе инфекция E. multilocularis была связана с садоводством; при работе с почвой следует использовать перчатки. | |
| FOOD-BORNE TREMATODE INFECTIONS | ПИЩЕВЫЕ ТРЕМАТОДНЫЕ ИНФЕКЦИИ | |
| Food-borne trematode infections are a group of zoonotic diseases caused by hepatic, intestinal, and pulmonary parasitic flukes. These infections are contracted by ingestion of infective parasites in under cooked aquatic food or water plants. In 2005, an estimated 56. 2 million people were infected with food-borne trematodes and 7. 9 million had severe sequelae of these infections | Пищевые трематодные инфекции представляют собой группу зоонозных заболеваний, вызываемых печеночными, кишечными и легочными паразитическими сосальщиками. Эти инфекции передаются при попадании инфекционных паразитов в организм человека из недостаточно приготовленной жидкой пищи, водорослей и других водных растений. По оценкам, в 2005 году 56, 2 миллиона человек были инфицированы трематодами пищевого происхождения, и у 7, 9 миллиона были зафиксированы тяжелые осложнения этих инфекций. | |
|
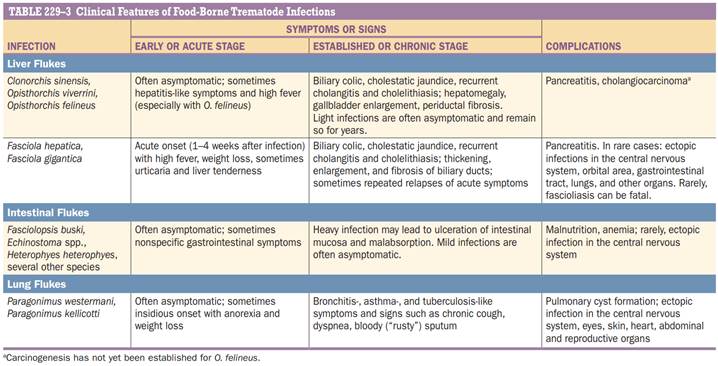
■ LIVER FLUKES The most important liver flukes causing human infections are the related species Opisthorchis viverrini and Opisthorchis felineus, which cause opisthorchiasis; Clonorchis sinensis, which causes clonorchiasis; and Fasciola hepatica and Fasciola gigantica, which cause fascioliasis (Table 229-1) | ■ ПЕЧЕНОЧНЫЕ СОСАЛЬЩИКИ Наиболее распространёнными печёночными сосальщиками, инфицирующие человека, являются родственные виды Opisthorchis viverrini и Opisthorchis felineus, вызывающие описторхоз; Clonorchis sinensis, вызывающий клонорхоз; и Fasciola hepatica и Fasciola gigantica, вызывающие фасциолез (Таблица 229-1) | |
|
Opisthorchiasis and Clonorchiasis | Описторхоз и клонорхоз | |
| O. viverrini is found mainly in northeastern Thailand, Laos, and Cambodia; O. felineus mainly in Europe and Asia, including the former Soviet Union; and C. sinensis in Asia, including Korea, China, Taiwan, Vietnam, Japan, and Asian regions of Russia. Parasite eggs excreted from infected humans or animals are ingested by a host snail (the first intermediate host), where they undergo several developmental stages. Cercariae are then released from the snail and penetrate(пенетрация) freshwater fish (the second intermediate host), encysting as metacercariae in the muscles or under the scales. Humans become infected by eating raw or undercooked fish from endemic countries. After ingestion, the metacercariae excyst in gastric juices and migrate via the duodenum, the ampulla of Vater, and the extrahepatic biliary system to the intrahepatic bile ducts | O. viverrini встречается в основном на северо-востоке Таиланда, Лаосе и Камбодже; O. felineus в основном в Европе и Азии, включая бывший Советский Союз; и C. sinensis в Азии, включая Корею, Китай, Тайвань, Вьетнам, Японию и азиатские регионы России. Яйца паразитов, выделяемые инфицированными людьми или животными, попадают в организм улитки-хозяина (первого промежуточного хозяина), где они проходят несколько стадий развития. Затем церкарии высвобождаются из улитки и проникают в пресноводную рыбу (второй промежуточный хозяин), энцистируя в виде метацеркарий в мышцах или под чешуей. Люди заражаются, употребляя в пищу сырую или недоваренную рыбу из эндемичных стран. После проглатывания метацеркарии высвобождаются под воздействием желудочного сока и мигрируют через двенадцатиперстную кишку, Фатерову ампулу и внепеченочную билиарную систему во внутрипеченочные желчные протоки. | |
| The clinical manifestations of infection with Opisthorchis species and C. sinensis are similar. Pathologic changes are typically seen in the bile ducts, liver(ливерка), and gallbladder (Table 229-3). Tissue damage and intense inflammation is caused by mechanical and chemical irritation and immune responses to worms or worm products, and chronic inflammation may result in the development of cholangiocarcinoma. Both O. viverrini and C. sinensis are classified by the IARC as definitely carcinogenic (class 1). Acute and light infections are mostly asymptomatic, but hepatitis-like signs and symptoms, with high fever and chills, have been reported, especially in O. felineus infections. In general, only heavily infected people have symptoms and severe complications (Table 229-3). | Клинические проявления заражения видами Opisthorchis и C. sinensis схожи. Патологические изменения обычно наблюдаются в желчных протоках, печени и желчном пузыре (Таблица 229-3). Повреждение тканей и интенсивное воспаление вызываются механическим и химическим раздражением и иммунными реакциями на глистов или их продукты, а хроническое воспаление может привести к развитию холангиокарциномы. И O. viverrini, и C. sinensis классифицируются МАИР как определенно вызывающие канцерогенез (класс 1). Острые и легкие инфекции в большинстве своем протекают бессимптомно, но сообщалось о признаках и симптомах, подобных гепатиту, с высокой температурой и ознобом, особенно при инфекциях O. felineus. Как правило, только у гиперинфицированных людей наблюдаются симптомы и тяжелые осложнения (Таблица 229-3). | |
| The diagnosis of these infections is based on microscopic identification of parasite eggs in stool specimens. The eggs of Opisthorchis are indistinguishable from those of Clonorchis. | Диагностика этих инфекций основана на микроскопическом выявлении яиц паразитов в образцах стула. Яйца Opisthorchis неотличимы от яиц Clonorchis. | |
|
Fascioliasis | Фасциолез | |
| Fascioliasis occurs in many areas of the world and usually is caused by Fasciola hepatica, a common liver fluke of sheep and cattle. F. hepatica is found in more than 50 countries on all continents except Antarctica; F. gigantica is less widespread. The areas with the highest known rates of human Fasciola infection are in the Andean highlands of Bolivia and Peru. In other areas where fascioliasis is found, human cases are sporadic. | Фасциолез встречается во многих регионах мира и обычно вызывается Fasciola hepatica, распространенной печеночной двуусткой овец и крупного рогатого скота. F. hepatica встречается более чем в 50 странах на всех континентах, кроме Антарктиды; Менее распространен F. gigantica. Районы с самыми высокими известными показателями инфицирования человека фасциолами находятся в высокогорных районах Анд в Боливии и Перу. В других регионах, где обнаружен фасциолез, случаи заболевания людей носят спорадический характер. | |
| Unlike the other liver flukes, Fasciola species have no second intermediate host, as their infectious metacercariae adhere directly to aquatic plants. Humans usually acquire infection by ingesting aquatic plants, such as watercress, that contain viable metacercariae or by drinking water with free metacercariae. | В отличие от других печеночных сосальщиков, виды Fasciola не имеют второго промежуточного хозяина, поскольку их инфекционные метацеркарии прикрепляются непосредственно к водным растениям. Люди обычно заражаются при употреблении в пищу водных растений, таких как кресс-салат, которые содержат жизнеспособные метацеркарии, или питьевой воды со свободными метацеркариями. | |
| After metacercariae have excysted in the duodenum, Fasciola species migrate through the intestinal wall into the body cavity, penetrate the liver capsule, and move through the liver into the bile ducts. This migration route is different from that of other liver flukes and gives rise to symptoms during the acute migratory phase; the parasites may cause tissue destruction, focal bleeding, and inflammation. Some migrating flukes may deviate from their usual route to cause ectopic infections. In the established latent stage of infection, the parasites may cause bile duct inflammation, resulting in thickening and expansion(экспансия) of the ducts, fibrosis, and ultimately biliary obstruction (Table 229-3). Although some infected people are asymptomatic in the latent phase, others may experience repeated relapses of acute manifestations | После удаления метацеркарий в двенадцатиперстной кишке виды Fasciola мигрируют через стенку кишечника в полость тела, проникают в капсулу печени и перемещаются через печень в желчные протоки. Этот путь миграции отличается от пути других печеночных сосальщиков и вызывает симптомы во время острой фазы миграции; паразиты могут вызывать разрушение тканей, очаговое кровотечение и воспаление. Некоторые мигрирующие сосальщики могут отклоняться от своего обычного маршрута, вследствие чего развиваются эктопические очаги поражения. На установленной латентной стадии инфекции паразиты могут вызывать воспаление желчных протоков, что приводит к утолщению и расширению протоков, фиброзу и, в конечном итоге, обструкции желчных путей (Таблица 229-3). Хотя у некоторых инфицированных людей латентная фаза протекает бессимптомно, у других могут наблюдаться рецидивы острых проявлений. | |
| The most widely used diagnostic approach is direct detection of Fasciola eggs by microscopic examination of stool or of duodenal or biliary aspirates. Eggs generally cannot be detected until 3–4 months after exposure, whereas antibodies to the parasite may become detectable 2–4 weeks after exposure. More than one stool specimen may be needed for diagnosis, especially in light infections | Наиболее широко используемый диагностический подход - прямое обнаружение яиц фасциол с помощью микроскопического исследования кала, дуоденальных или желчных аспиратов. Яйца обычно не могут быть обнаружены до 3–4 месяцев после контакта, тогда как антитела к паразиту могут быть обнаружены через 2–4 недели после контакта. Для диагностики может потребоваться более одного образца кала, особенно при легких инфекциях. | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|