
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Типы химических связей
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней. Различают три основных типа химической связи: ковалентную, ионную, металлическую. В таблице 3. приведены основные отличительные признаки различных типов химической связи.
Таблица 3. Типы химической связи и их основные отличительные признаки
| Химичес-кая связь | Связываемые атомы | Процесс в электронной оболочке | Образую-щиеся частицы | Кристаллическая решетка | Характер вещества | Пример |
| Ионная | Атом металла и атом неметалла | Переход валентных электронов | Положительные и отрицатель-ные ионы | Ионная | Солеобразный | NaCl CaO NaOH |
| Ковален ная | Атомы неметаллов (реже-атомы металлов) | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2 C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | |||
| Металли-ческая | Атомы металлов | Отдача валентных электронов | Положительные ионы и электрон-ный газ | Металлическая | Металличес-кая | Металлы и сплавы |
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного и того же элемента и тогда она неполярная. Такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная. Такая ковалентная связь существует в молекулах H2O, NF3, CO2. Более электроотрицательные элементы будут оттягивать общие электроны от элементов менее электроотрицательных. Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.

Для наглядного изображения ковалентной связи в химических формулах используются точки (каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре).
Связи в молекуле Cl2 можно изобразить так:
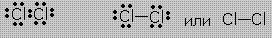
Такие записи формул равнозначны. Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решётки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
С позиции теории Бора образование ковалентной связи объясняется тенденцией атомов преобразовывать свой внешний слой в октет (полное заполнение до 8 электронов). Оба атома представляют для образования ковалентной связи по одному неспаренному электрону, и оба электрона становятся общими.
Образование молекулы хлора.
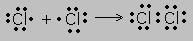
При расстановке следует соблюдать правило: электроны ставятся в определённой последовательности - слева, сверху, справа, снизу по одному, затем добавляют по одному, неспаренные электроны принимают участие в образовании связи. Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков:
| s-s- связь | 
|
| s-p- связь | 
|
| p-p- связь | 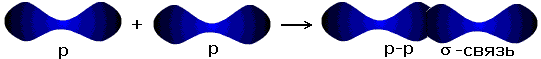
|
| p-p- связь | 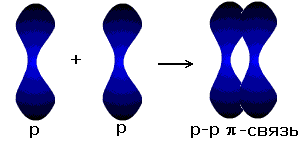
|
σ - связь значительно прочнее π -связи, причём π -связь может быть только с σ -связью, За счёт этой связи образуются двойные и тройные кратные связи.
Донорно-акцепторная связь является частным случает ковалентной связи. Механизм образования такой связи заключается в том, что собственная электронная пара одного атома (донора) переходит в общее пользование донора и другого атома, который предоставляет свободную орбиталь (акцептора). Такой тип связи хорошо иллюстрирует образование иона аммония - NH4 +.
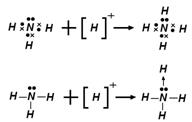
Атом азота предоставляет по одному электрону трем атомам водорода для образования ковалентной связи. При этом у азота остается собственная неподеленная электронная пара, которую он может предоставить для образования связи с ионом водорода, у которого нет электрона, но есть незаполненный электронный уровень. В качестве доноров электронных пар обычно выступают атомы с большим количеством электронов, но имеющих небольшое число неспаренных электронов. Например: азот, кислород, фосфор, сера.
Ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, и любая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединении электронов. При отдаче электронов образуется положительно заряженный ион - катион, при присоединении - отрицательный ион - анион. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электронов на внешнем слое, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа.
Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Эти вещества при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения (табл. 4).
Таблица 4. Температуры плавления и кипения соединений с ионной связью
| Вещество | NaCl | NaOH | KBr | BaF2 | BaCl2 |
| Свойство | |||||
| t пл 0С | |||||
| t кип 0С |
Металлическая связь. Металлы и их сплавы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической решётки ионы, более или менее свободно перемещаются в пространстве между катионами и обуславливают электрическую проводимость металлов. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной возникновения металлической связи. Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличие от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах
Водородная связь и ван-дер-ваальсово взаимодействие. Данные виды связи лишь условно можно назвать химическими и правильней их относить к межмолекулярным и внутримолекулярным взаимодействиям. Водородная связь возникает между связанным атомом водорода одной молекулы и электроотрицательным атомом другой молекулы. Водородная связь имеет частично электростатическую, а частично донорно-акцепторную природу. Наглядным примером реализации такой связи может служить объединение нескольких молекул воды в кластеры. В молекуле воды атом кислорода смещает на себя электронную плотность, приобретая частичный отрицательный заряд, а водород соответственно - частично отрицательный и может взаимодействовать с неподеленной электронной парой кислорода соседней молекулы. Водородная связь может возникать не только между разными молекулами, но и внутри самой молекулы.
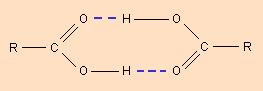
Ван-дер-ваальсово взаимодействие возникает за счет возникновения наведенных дипольных моментов. Такой вид взаимодействия может возникать как между разными молекулами, так и внутри одной молекулы между соседними атомами за счет возникновения дипольного момента у атомов при движении электронов. Образование межмолекулярной водородной связи.
Ван-дер-ваальсово взаимодействие может быть притягивающим и отталкивающим. Межмолекулярное взаимодействие носит характер притяжения, а внутримолекулярное - отталкивания. Внутримолекулярное ван-дер-ваальсово взаимодействие оказывает существенный вклад в геометрию молекулы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|