
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Уравнение состояния идеального газа
Уравнение состояния идеального газа
При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова

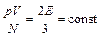
Поэтому Q можно рассматривать как меру температуры в энергетических величинах – Дж
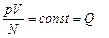
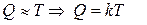
k – постоянная Больцмана k=1, 38•10-23 Дж/К
Постоянная Больцмана связывает температуру Q в энергетических величинах с температурой Т в кельвинах
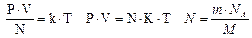
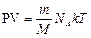
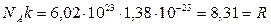
[R]=Дж/(моль·К) – универсальная газовая постоянная
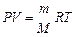
уравнение состояния идеального газа, или уравнение Клапейрона–Менделеева
m, M, R – постоянные величины отсюда вытекает уравнение Клапейрона: для данной массы, данного газа
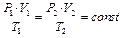
Газовые законы
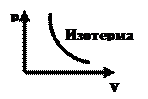 Процессы, в которых один из параметров (p, V или T) остается неизменным называются изопроцессами
Процессы, в которых один из параметров (p, V или T) остается неизменным называются изопроцессами
1. Изотермический процесс
Закон Бойля – Мариотта m, T=const PV=const
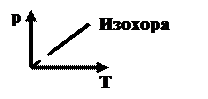 |
2. Изохорный процесс
Закон Шарля
|
|
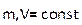
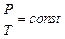
|
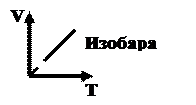 | |||
| |||
3. Изобарный процесс
Закон Гей – Люссака m, P=const 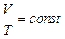
Формуды для задач:
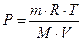
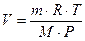
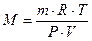
P=ν ∙ R∙ T
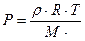
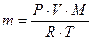
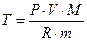
Самостоятельная работа «Уравнение Менделеева – Клайперона»
1. Какой газ находится в баллоне объемом 2 м³ при температуре 10º С и давлении 2·10 Па, если его масса равна 8 кг? (найти молярную массу М)
2. Рассчитайте плотность воздуха при температуре 200С и давлении 10 Па
3. Кислород, молярная масса которого М=0, 032 кг/моль находится при температуре Т=500К. При объеме 1 м3 имеет давление Р=2∙ 106 Па. Определить массу этого газа.
4. Газ массой 3 кг имеет объем 0, 5 м3 Молярная масса этого газа М=0, 04 кг/моль при температуре 300К. Определить давление этого газа
5. Определить объем азота молярной массой 0, 028 кг/моль и массой 5 кг, если при температуре 600К его давление 6∙ 105 Па
6. Определить температуру углекислого газа, имеющего молярную массу 0, 044 кг/моль, если 2 кг его занимают объем 0, 9 м3 при давлении 5∙ 105 Па
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|