
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Теоретическая часть:. Задание 1.На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Теоретическая часть:
Количество продукта, рассчитанное по уравнению, является максимально возможным значением (теоретическое значение, mтеор). На практике из-за потерь обычно получают меньшее количество (практическое значение, mпракт., mпракт < mтеор).
Практический выход продукта определяется отношением его практического количества к теоретическому: ᶮ = 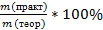
При получении продукта в газообразном или жидком состоянии часто определяют отношение не масс, а объемов готового вещества. В этом случае вычисляют объемную долю выхода продукта: ᶮ = 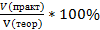
Задание 1. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Алгоритм решения
| Дано: m(НNО3)=252 г ω (соли)=90% | Решение:
1. Составим уравнение химической реакции
NаОН + НNO3 = NаNO3+Н2О
2. В уравнении подчеркнем формулы веществ, которые записаны в «дано» и «найти»
NаОН + НNO3 = NаNO3+Н2О
3. Под подчеркнутыми формулами подпишем по коэффициентам число моль
NаОН + НNO3 = NаNO3+Н2О
1 моль 1 моль
4. Вычислим количество вещества n
 n(НNO3=
n(НNO3= 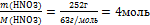 5. Подпишем найденное n под формулой этого вещества
NаОН + НNO3 = NаNO3+Н2О
1 моль 1 моль
4 моль
6. Под формулой вещества, массу которого надо найти поставим х моль
NаОН + НNO3 = NаNO3+Н2О
1 моль 1 моль
4 моль х моль
8. Из полученной пропорции выразим х
1 моль 1 моль
4 моль х моль
5. Подпишем найденное n под формулой этого вещества
NаОН + НNO3 = NаNO3+Н2О
1 моль 1 моль
4 моль
6. Под формулой вещества, массу которого надо найти поставим х моль
NаОН + НNO3 = NаNO3+Н2О
1 моль 1 моль
4 моль х моль
8. Из полученной пропорции выразим х
1 моль 1 моль
4 моль х моль
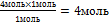 это количество вещества n(NаNO3)
9. Зная n(NаNO3) найдем массу NаNO3
m=nM
m (NаNO3)= n (NаNO3)
это количество вещества n(NаNO3)
9. Зная n(NаNO3) найдем массу NаNO3
m=nM
m (NаNO3)= n (NаNO3) 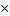 M (NаNO3)
M (NаNO3=23+ 14+16 M (NаNO3)
M (NаNO3=23+ 14+16 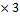 =85г/моль
m(NаNO3)=4 =85г/моль
m(NаNO3)=4 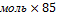 г/моль=340г – теоретическая масса соли
10. Вычислим практическую массу полученной соли
340 г - 100%
Х г - 90%
х = г/моль=340г – теоретическая масса соли
10. Вычислим практическую массу полученной соли
340 г - 100%
Х г - 90%
х = 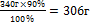 - практическая масса NаNO3
- практическая масса NаNO3
|
Определить  : m (NаNO3) : m (NаNO3)
| m (NаNO3) =306 г |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|