
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ. а эти простые вещества – аллотропными видоизменениями или модификациями.
Билет № 10
1. Неметаллы, положение в периодической системе химических элементов Д. И. Менделеева, химические свойства.
Положение в ПСЭ – правый верхний угол от диагонали B – At.
Неметаллы – преимущественно p-элементы (кроме H и He – s-элементы), содержат на внешнем электронном уровне большое число электронов, прочно связанных с ядром. У типичных неметаллов электронная оболочка завершена (инертные газы) или близка к завершению (галогены, халькогены).
| Радиус атома | Относительная Э. О. | |
| В периоде | уменьшается | увеличивается |
| В группе | увеличивается | уменьшается |
Строение простых веществ:
а) Одноатомные молекулы – инертные газы (He, Ne, Ar, Kr, Xe, Rn)
б) Двухатомные молекулы: O2, N2, H2, Cl2, Br2, I2, F2 – связаны неполярными ковалентными связями.
в) Многоатомные молекулы: O3 – озон, P4 – белый фосфор, S8 – ромбическая сера – неполярные ковалентные связи, молекулярные кристаллические решётки.
г) Полимерные молекулы: (C)n, (B)n, (Si)n – связь ковалентная неполярная, кристаллическая решётка – атомная.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
1. Молекулярное строение. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому при обычных условиях большинство таких веществ представляют собой газы или твердые вещества с низкими температурами плавления и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы " одноатомными молекулами".
2. Атомное строение. У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления. Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
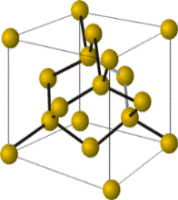
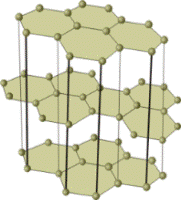
Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги в книге.
Многие элементы-неметаллы образуют несколько простых веществ − аллотропных модификаций.
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ. а эти простые вещества – аллотропными видоизменениями или модификациями.
Аллотропия может быть связана и с разным составом молекул − различным числом атомов в молекуле (O2 и O3), и с разным строением кристаллов. Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Агрегатные состояния:
Твёрдые: C, Si, B, P, S
Жидкие: B2
Газообразные: H2, O2, N2, F2, Cl2 и т. д.
Химические свойства:
С электронной точки зрения могут отдавать электроны (быть восстановителями) и принимать (быть окислителями).
| I. Окислительные свойства | II. Восстановительные свойства |
| 1) С металлами: 2Na0 + Cl20 → 2Na+1Cl–1 в-ль ок-ль Na0 – 1ē → Na+1 | 2 Cl20 + 2ē → 2Cl–1 | 1
2) С водородом: H20 + S0 в-ль ок-ль | 1) С кислородом: S + O2 → SO2 в-ль ок-ль |
| F2 не может быть восстановителем так как обладает самой высокой ЭО. |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
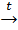 H2+1S–2
H2+1S–2