
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Семинар по теме «Фазовое равновесие в однокомпонентных системах» № 2
1. Определить температуру кипения хлорбензола при 26, 66 кПа (200 мм рт. ст. ), если его нормальная температура кипения 405, 4 К, а при 53, 33 кПа (400 мм рт. ст. ) он кипит при температуре 383, 2 К. Вычислить теплоту испарения, изменение энтропии, внутренней энергии, энергии Гиббса и энергии Гельмгольца при испарении 1 моль хлорбензола при нормальной температуре кипения.
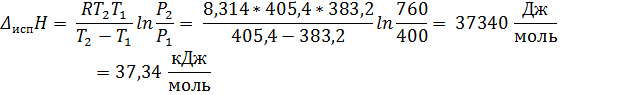
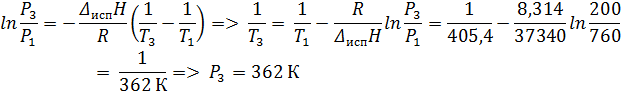
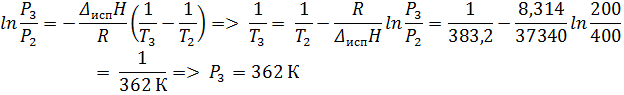
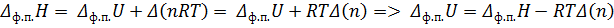
, где 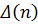 изменение количества газообразных веществ, в случае испарения:
изменение количества газообразных веществ, в случае испарения:
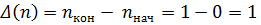
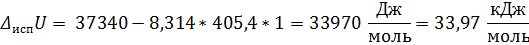
Для любого равновесного фазового перехода 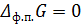
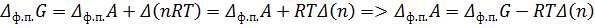
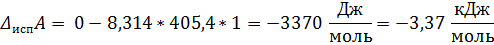
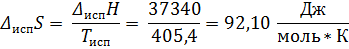
Ответ: Т = 362 К; ∆ Нисп = 37, 34 кДж/моль; ∆ Sисп = 92, 10 Дж/(моль * К); ∆ Uисп = 33, 97 кДж/моль; ∆ Gисп = 0 кДж/моль; ∆ Аисп = -3, 37 кДж/моль.
2. Зависимость давления (Па) насыщенного пара от температуры для фреона CCl2F2 выражается уравнением lgP = 34, 5 – 2406, 1/T – 9, 26lgT + 0, 0037T. Определить давление насыщенного пара, теплоту испарения, изменение энтропии, энергии Гиббса и теплоёмкости при испарении 1 моля фреона при 298 К.
Подставив в исходное уравнение температуру рассчитаем давление насыщенного пара над фреоном:
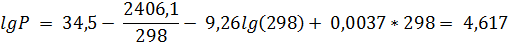
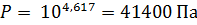
Для расчёта остальных функций переведём логарифм в натуральный:
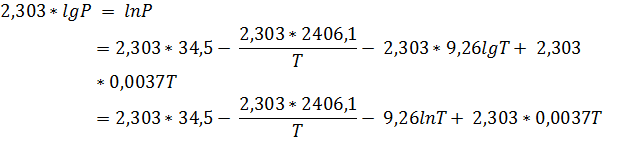
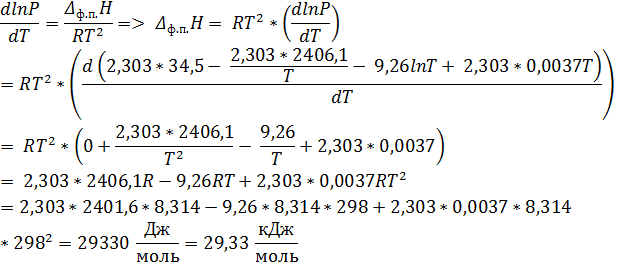
По закону Кирхгоффа:
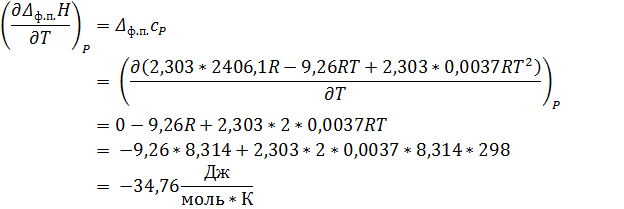
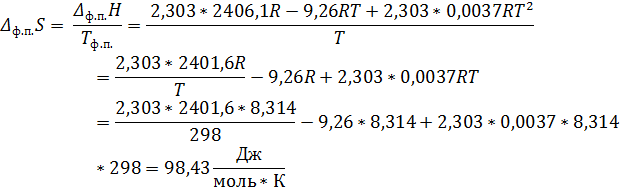
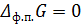
Ответ: P = 4, 14 * 104 Па; ∆ Нисп = 29, 33 кДж/моль; ∆ Sисп = 98, 43 Дж/моль К; ∆ Gисп = 0 кДж/моль; ∆ СP = -34, 76 Дж/моль К.
3. На основании справочных данных о значениях температуры кипения при различном внешнем давлении рассчитайте температурный коэффициент давления насыщенного пара (dP/dT) для метилового спирта при нормальной температуре кипения. Теплоту испарения метанола в интервале 45 – 65 º С принять постоянной величиной.
Для самостоятельного решения.
Ответ: P1 = 400 мм рт. ст.; Т1 = 49, 9 º С; P2 = 760 мм рт. ст.; Т2 = 64, 5 º С (стр. 30 спр. Равделя); ∆ Нисп = 39, 87 кДж/моль; dP/dT = 4261 Па/К.
4. При 1, 01 * 105 Па и -38, 87 º С жидкая ртуть имеет плотность 13, 69 г/см3, а твёрдая 14, 19 г/см3. Рассчитайте температуру плавления ртути при давлении 3 * 108 Па, если удельная теплота плавления ртути равна 9, 74 Дж/г.
Запишем уравнение Клаузиуса:

Разделим переменные:
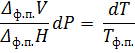
Необходимо выразить разницу между объёмами твёрдой и жидкой фаз через имеющиеся плотности ртути:
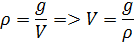
, где 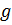 масса вещества
масса вещества
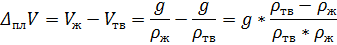
Если в качестве массы взять величину равную молярной массе, то получится молярное изменение объёма, если 1 кг – то изменение объёма при плавлении 1 килограмма ртути. Поскольку теплота плавления дана в Дж/г, в качестве массы удобнее брать 1 кг и все используемые величины переводить в систему СИ. Тогда:
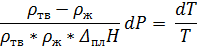
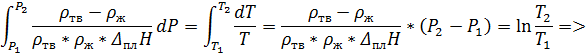
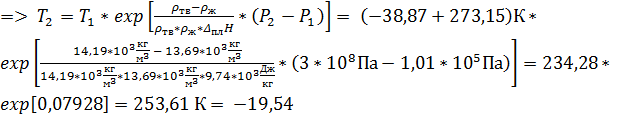 º С
º С
Ответ: 253, 61 К.
5. Зависимость температуры плавления калия от давления (атм), по Бриджмену, выражается уравнением
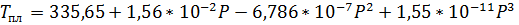 .
.
Определите температуру плавления и теплоту плавления при давлениях 1, 6 атм и 12000 атм, если изменение объёма 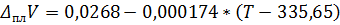 , см3/г.
, см3/г.
Рассчитаем температуры плавления:
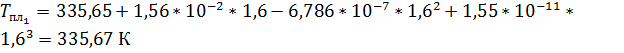
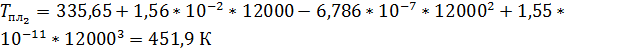
Запишем уравнение Клаузиуса:
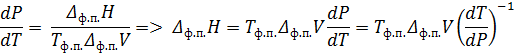
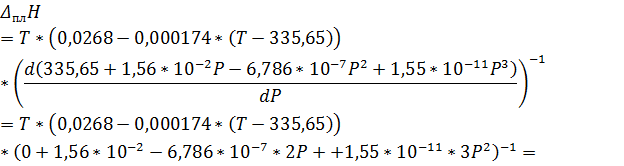
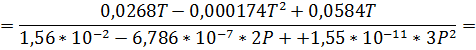
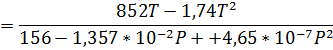
Обратите внимание, что знаменатель был получен из уравнения зависимости температуры от давления, выраженного в атмосферах. Т. е. приведённые коэффициенты имеют смысл, только при подстановке давления в атмосферах. Числитель же содержал зависимость объёма от температуры выраженную в см3/г. Таким образом, рассчитывая теплоту плавления по уравнению выше ответ будет получаться в 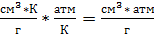 .
.
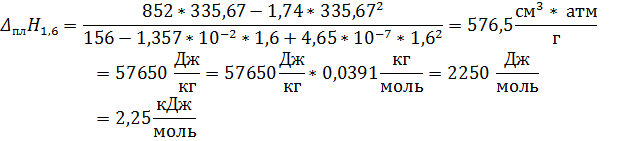
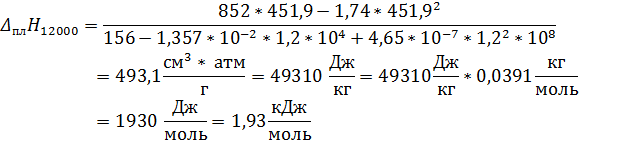
Ответ: Тпл1 = 335, 67 К; Тпл2 = 451, 9 К; Δ плH1 = 2, 25 кДж/моль; Δ плH2 = 1, 93 кДж/моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|