
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Двадцать газов 11 страница
С ростом температуры увеличится энергия, а также вероятность накопления достаточного ее количества для появления высокочастотных «атомов энергии». При 6000 °C основное излучение будет идти «атомами энергии» видимой части спектра, но еще более крупных «атомов энергии» ультрафиолетовой части спектра будет образовываться мало.
Но каков размер «атома энергии»? Сколько энергии он заключает в себе? Так как «сколько» являлось ключевым вопросом, Планк с восхитительной прямотой назвал «атом энергии» квантом, что на латыни означает именно «сколько».
В формуле Планка, определяющей распределение излучения черного тела, размер кванта должен быть прямо пропорционален частоте излучения. Чтобы выразить это математически, давайте обозначим размер кванта, или количество заключенной в нем энергии, символом e (энергия). Частота излучения всегда обозначается физиками греческой буквой «ню» ν.
Если энергия e пропорциональна частоте ν, тогда e равно ν, умноженной на некую постоянную величину. Эта величина получила название постоянная Планка и обычно обозначается буквой h. Формула, определяющая размер кванта для определенной частоты излучения, имеет вид:
e = hν (формула 1).
Эта формула была представлена миру в 1900 году — на грани, отделившей классическую физику от современной. В классической физике поток энергии считался непрерывным, в современной физике он представляется в виде набора квантов. Иными словами, в классической физика величина h считалась равной 0; в современной физике она имела величину отличную от 0.
Это все равно что перестать рассматривать процесс движения как плавное скольжение и начать считать его серией отдельных шагов.
Путаницы не будет, если шаги будут большими, внушительными. В таком случае движение шагом и скольжение никак не спутаешь. Но как быть, если некто семенит крошечными, микроскопическими шажками, каждый из которых производится за ничтожную долю секунды. Беглым взглядом такое движение от скольжения никак не отличишь. Только при самом тщательном наблюдении можно обнаружить, что голова идущего слегка покачивается при каждом шаге. Чем короче шаги, тем сложнее отличить их от скольжения.
Так и в физике. Все зависит от размера отдельных квантов и от того, насколько «зернистой» является энергия. Размеры квантов зависят от величины постоянной Планка. Давайте рассмотрим, что она собой представляет.
Из формулы 1 получается:
h = e/ν (формула 2).
Энергию часто измеряют в эргах (см. главу 13), частоту — в единицах в секунду (1/сек).
Если эрг разделить на 1/сек, получится эрг-сек — единица измерения постоянной Планка. Единица, получаемая в результате умножения энергии на время, называется физиками единицей воздействия. То есть постоянная Планка выражается единицами воздействия.
Абсолютно все во Вселенной зависит от величины единицы воздействия. Так Планк обнаружил ту самую единицу. (Насколько я знаю, многие ученые были заняты поисками такой единицы, но зачем? Ведь Планк уже ее нашел. )
Какова же точная величина h? Планк выяснил, что она чрезвычайно мала: 0, 0000000000000000000000000066256 эрг-сек, или 6, 6256 × 10-27 эрг-сек.
Попробую продемонстрировать более наглядно, насколько она мала. Человеческое тело в среднем потребляет и расходует 2500 ккал в день. 2500 ккал = 2 500 000 кал.
Поэтому для человека 1 калория — величина очень маленькая, равная 1/2 500 000 дневных запасов каждого из нас. Это количество энергии, содержащееся в 1/113 000 унции сахара.
А теперь представьте, что перед вами книга весом 1 фунт. Вам необходимо поднять ее и поставить на полку, находящуюся на высоте 3 фута от пола. Для этого потребуется затратить энергию, равную приблизительно 1 калории.
Представьте, что величина постоянной Планка была бы другого порядка — например, 1 кал-сек. Тогда наша Вселенная стала бы воистину странным местом. Для того чтобы поднять книгу, вам пришлось бы ждать, пока будет накоплено достаточное количество энергии для создания кванта гигантских размеров, необходимого для столь масштабного действия. Когда же энергия накопится, книга внезапно окажется в трех футах от пола.
1 кал-сек = 41 850 000 эрг-сек, и, поскольку постоянная Планка составляет ничтожную долю одной эрг-секунды, 1 кал-сек = 6 385 400 000 000 000 000 000 000 000 000 000 h = 6, 3854 × 1033 h. Иначе говоря, в 1 калории-секунде содержится невероятное количество постоянных Планка.
Следовательно, любое действие, и такое, как подъем 1-фунтовой книги, выполняется при помощи бесчисленного количества шажков. Но они такие маленькие, что все движение неотличимо от беспрерывного скольжения.
Когда Планк в 1900 году впервые представил общественности свою квантовую теорию, она почти не вызвала к себе интереса. Квант был воспринят как понятие придуманное, так сказать, возникшее из воздуха. Даже сам Планк пребывал в сомнении, но не по поводу формулы, описывающей излучение черного тела, которая отлично работала. Он сомневался в своем детище — кванте, эту формулу объяснявшем.
А затем наступил 1905 год, и 26-летний физик-теоретик Альберт Эйнштейн опубликовал сразу пять научных работ, каждой из которых было достаточно, чтобы завоевать ему славу звезды первой величины на небосводе физической науки.
В двух работах он разработал теоретические основы «броуновского движения» и случайно создал механизм определения действительных размеров атомов.
Третья работа была посвящена «фотоэлектрическому эффекту». В ней было ясно показано, что, хотя классическая физика не в состоянии его объяснить, с этим делом прекрасно справляется квантовая теория Планка.
Последнее вызвало откровенное недоумение в среде физиков. Планк ввел понятие кванта исключительно для того, чтобы описать излучение абсолютно черного тела, а оказалось, что его теория заодно объясняет и фотоэлектрический эффект, то есть нечто совершенно другое! А раз кванты оказались уместны в двух различных областях, вполне вероятно, что они действительно существуют.
(Четвертая и пятая работы Эйнштейна предлагали новый взгляд на Вселенную, который мы теперь называем «Специальной теорией относительности». Именно в них он впервые привел формулу e = mc2. См. главу 13. )
Работы по относительности были продолжены, и в 1915 году появилась общая теория относительности, благодаря которой имя Эйнштейна известно далеко за пределами мира физики. Забавно, но Нобелевской премии (которую ученый получил в 1921 году) он был удостоен не за теорию относительности, а за работы по фотоэлектрическому эффекту.
Величина h настолько мала, что в повседневной жизни мы вполне можем ею пренебречь. В масштабных событиях, происходящих ежедневно, потоки энергии могут считаться непрерывными. В первом приближении.
Однако, если мы имеем дело с небольшими изменениями энергии, квантовые шаги, посредством которых эти изменения происходят, становятся больше. Так, лестница, состоящая из ступенек высотой 1 мм и глубиной 3 мм, для человека ростом (1 футов покажется просто шероховатой наклонной плоскостью. А если человек имеет рост муравья, каждая из этих ступенек станет для него серьезным препятствием, на преодоление которого потребуется затратить изрядное усилие. А для человека, уменьшившегося до размеров бактерии, они станут непреодолимыми горами.
Точно так же, когда мы пытаемся проникнуть во внутренний мир атома, квантовые ступеньки становятся гигантскими. Об атомной физике невозможно говорить в терминах физики классической. Даже в первом приближении.
Первым ученым, осознавшим это, был датский физик Нильс Бор. В 1913 году Бор доказал, что, если электрон поглощает энергию, он должен поглотить сразу целый квант, причем для электрона квант — это много. Поэтому после этого он резко меняет свое отношение к остальной части атома.
Бор изобразил электрон вращающимся вокруг атомного ядра по фиксированной орбите. Поглотив квант энергии, он неожиданно оказывается на орбите, расположенной дальше от ядра, причем это перемещение рядовое, без промежуточных этапов.
Поскольку, по Бору, электрон мог двигаться только по определенным орбитам, атом мог поглотить только кванты определенного размера, достаточно большие, чтобы электрон переместился с одной допустимой орбиты на другую. Если же электроны перемещаются в обратном направлении, они излучают энергию квантами. Причем частота излучения определяется размером кванта, который испускается при переходе электрона с одной орбиты на другую.
Так получила разумное объяснение наука спектроскопия. Люди начали понимать, почему каждый элемент (состоящий из атомов одного типа, имеющих один тип энергетических взаимоотношений между электронами этого атома) испускает излучение только определенных частот, будучи раскаленным. Они также поняли, почему вещество, способное поглощать излучение определенных частот, может также испускать излучение тех же частот при других условиях.
Короче говоря, Кирхгоф затронул проблему, но его эмпирические выводы получили теоретическое объяснение много позже.
Первая модель атома, предложенная Бором, была очень простой. Но он не прекращал своих исследований, которые позже были продолжены его последователями, и постепенно представление об атоме менялось, модель также становилась более сложной. Появилась возможность точнее объяснить данные, полученные опытным путем. В 1926 году австриец Эрвин Шрёдингер создал математический аппарат, способный описать движение частиц внутри атома на основе квантовой теории. Его работа получила название квантовой механики, в противоположность существовавшей классической механике, основанной на трех законах Ньютона. Именно квантовая механика является основой современной физики.
Глава 15
Приветствую тебя, незнакомец
В науке, как и везде, существует мода. Проведите необыкновенно успешный эксперимент, и у вас появится дюжина подражателей раньше, чем вы успеете об этом подумать.
Взять хотя бы химический элемент ксенон, открытый в 1898 году Уильямом Рамзаем и Моррисом Уильямом Траверсом. Как и другие элементы этой группы, он был изолирован от жидкого воздуха. О присутствии этих элементов в воздухе никто не подозревал на протяжении века, в течение которого велось активное исследование химического состава воздуха. Исследователи были немало удивлены, обнаружив странного незнакомца. Кстати, название ксенон произошло от греческого слова странный, не знакомый.
Ксенон принадлежит к группе элементов, называемых инертными газами (по причине их химической инертности). Их также называют редкими газами (они редко встречаются) или благородными газами (обособленное положение, которое они занимают по причине своей химической инертности, может показаться признаком особой значительности).
Ксенон — самый редкий из стабильных инертных газов и самый редкий из всех устойчивых химических элементов на Земле. Ксенон встречается только в атмосфере, где составляет 5, 3 весовых единиц на миллион. Наша атмосфера весит 5 500 000 000 000 000 (5, 5 квадриллионов) тонн, — это означает, что запас ксенона на планете 30 000 000 000 (30 миллиардов) тонн. На первый взгляд это много, но выделить атомы ксенона из огромного количества остальных составляющих частей атмосферы — весьма сложная задача. Поэтому ксенон не является обычным элементом и никогда таким не станет.
Да и в химических лабораториях ксенон вовсе не популярен. Его химические и физические свойства были определены, но что с ними делать дальше? Уже будучи открытым, ксенон долгое время оставался чужаком в семье химических элементов.
Но затем в 1962 году было объявлено о проведении необычного эксперимента с участием ксенона. И с тех пор ни один из номеров специальных химических журналов не обходится без статей о ксеноне.
Что же произошло?
Вы ждете быстрого и краткого ответа? Тогда вы плохо меня знаете. Я, как всегда, выберу свой любимый кружной путь и начну с того, что ксенон является газом.
Стать газом — это дело случая. Ни одно вещество не является газом от природы, просто иногда это диктуется температурными условиями. На Венере вода и аммиак — газы. На Земле аммиак — газ, а вода — жидкость. На Титане ни одно из этих веществ газом не является.
Далее мне потребуется некий критерий, который поможет в дальнейших рассуждениях. Пусть, например, любое вещество, остающееся в газообразном состоянии при -100 °C (-148° F), является Газом (с прописной буквы). Такая температура никогда не достигается на Земле даже в Антарктике, славящейся своими зверскими зимами, поэтому Газов на Земле нет, только газообразное состояния отдельных веществ (или полученных в химических лабораториях).
Тогда почему Газ — это Газ?
Для начала скажу, что любое вещество состоит из атомов или групп атомов, называемых молекулами. Между атомами или молекулами действуют силы притяжения, удерживающие их рядом. Тепло сообщает этим атомам или молекулам определенную кинетическую энергию, которая стремится оторвать их друг от друга, потому что каждый атом и молекула знают, куда им хотелось бы отправиться. (Поймите меня правильно, я вовсе не хочу сказать, что атомы знают, что делают, то есть обладают сознанием. Просто это мой телеологический[9] способ ведения беседы. И пусть телеология запрещена для использования в научных статьях, но… сладок именно запретный плод. )
Силы притяжения между определенными атомами или молекулами обычно постоянны, однако кинетическая энергия изменяется с изменением температуры. Поэтому, если температура поднимется достаточно высоко, любая группа атомов или молекул разлетится по сторонам и вещество станет газом. При температуре выше 6000 °C все известные вещества становятся газами.
Конечно, существует очень немного веществ, межатомные или межмолекулярные силы в которых настолько велики, что для их преодоления необходим нагрев до 6000 °C. У многих веществ они, напротив, настолько слабы, что тепло обычного солнечного дня сообщает достаточно энергии для перехода в газообразное состояние. Пример — обычный медицинский анестетик.
У других веществ силы межмолекулярного притяжения еще слабее, и для их поддержания в газообразном состоянии вполне достаточно тепла при температуре -100 °C. Они являются Газами, о которых я веду речь.
Межмолекулярные или межатомные силы возникают из-за распределения электронов в атомах или молекулах. Электроны распределены среди различных электронных оболочек, согласно системе, в подробности которой я вдаваться не буду. Например, атом алюминия содержит 13 электронов, распределенных следующим образом: 2 — во внутренней оболочке, 8 — в следующей, 3 — в наружной. Таким образом, распределение электронов в атоме алюминия можно обозначить следующим образом: 2, 8, 3. Внутренняя оболочка может содержать только 2 электрона, следующая — 8 электронов, а каждая из последующих может содержать больше 8 электронов. Если не считать ситуации, когда только внутренняя оболочка содержит электроны, у атомов в стабильном состоянии в наружной оболочке 8 электронов.
Известно шесть элементов, находящихся в состоянии максимальной стабильности.
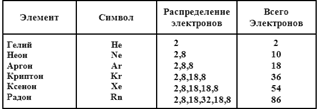
Другие атомы, где электроны распределены не так удачно, вынуждены пытаться достичь этого, захватывая дополнительные электроны или освобождаясь от имеющихся. В процессе этого они подвергаются химическим превращениям. Однако атомы шести перечисленных выше химических элементов не нуждаются в подобных ухищрениях. Они вполне самодостаточны. У них нет необходимости в перемещении электронов, поэтому они не принимают участия в химических реакциях и являются инертными. (По крайней мере, именно это я заявил бы до 1962 года. )
Атомы семейства инертных газов являются настолько самодостаточными, что эти атомы даже игнорируют друг друга. Между ними существует очень слабое притяжение, и эти вещества остаются газами при комнатной температуре. Все, кроме радона, являются Газами.
Какое-то притяжение между атомами, конечно, существует (в природе нет атомов или молекул, между которыми притяжение отсутствует вообще). Если некоторое время понижать температуру, наступит момент, когда силы притяжения возобладают над разрушительным действием кинетической энергии, и инертные газы станут инертными жидкостями.
А как обстоят дела с другими элементами? Как я уже говорил, в их атомах электроны распределены так, что обеспечивают устойчивость ниже максимальной. Каждый обладает тенденцией к перераспределению электронов в сторону увеличения устойчивости. Например, в атоме натрия Na электроны распределены следующим образом: 2, 8, 1. Избавившись от электрона во внешней оболочке, он приобрел бы устойчивое распределение 2, 8, как у атома неона Ne. Атом хлора Cl имеет распределение 2, 8, 7. Если бы он смог приобрести один электрон во внешнюю оболочку, получился бы вполне устойчивый атом 2, 8, 8 — такое распределение электронов у инертного аргона.
Следовательно, если атом натрия встретится с атомом хлора, перенос электрона из одного атома в другой устроит обоих. Однако потеря отрицательно заряженного электрона оставляет атом натрия с дефицитом отрицательного заряда, что создает избыток положительного заряда. Атом превращается в положительно заряженный ион (Na+). Атом хлора, получивший дополнительный электрон, приобрел избыточный отрицательный заряд и стал отрицательно заряженным ионом (Cl-).
Разноименные заряды притягиваются, поэтому ионы с разными зарядами окажутся притянутыми друг к другу. Сильное притяжение не может быть преодолено кинетической энергией, которой обладают атомы при комнатной температуре, поэтому ионы держатся друг за друга достаточно крепко, чтобы образовавшееся вещество NaCl — обычная поваренная соль — было твердым. Оно не переходит в газообразное состояние до достижения температуры 1413 °C.
Теперь рассмотрим атом углерода. Распределение электронов — 2, 4. При потере 4 электронов он мог бы приобрести устойчивую конфигурацию 2, как в атоме гелия. При приобретении 4 электронов конфигурация стала бы 2, 8, как в атоме неона, тоже устойчивая. Приобрести или избавиться от такого количества электронов сразу весьма непросто, поэтому атом углерода предпочитает понемногу делиться своими электронами. Он может выделить один электрон в совместное пользование своему соседу, который также отдаст для этой цели один электрон. В результате у двух соседних атомов углерода два электрона будут общими. Другой электрон можно выделить для совместного владения с другим соседом и т. д. Поэтому каждый атом углерода обычно окружен четырьмя другими.
Эти электроны совместного пользования помещаются во внешней оболочке каждого атома углерода, внесшего свою долю. Каждый атом углерода имеет во внешней оболочке четыре собственных электрона и четыре заимствованных от соседей (по одному от каждого). Таким образом, каждый атом углерода имеет конфигурацию неона 2, 8, являющуюся устойчивой, но только оставаясь очень близко к соседям. Результатом является сильное межатомное притяжение даже без участия разноименных электрических зарядов. Углерод — твердое вещество и переходит в газообразное состояние только при нагревании выше 4200 °C.
Атомы металлов также очень плотно прилегают друг к другу (по аналогичным причинам), и, к примеру, вольфрам переходит в газообразное состояние только при достижении температуры 5900 °C.
Таким образом, мы вряд ли можем ожидать появление Газа, если атомы достигают устойчивости, передавая друг другу электроны и получая электрический заряд или делясь электронами с соседями, в результате чего атомы «склеиваются» друг с другом.
Нам необходимо нечто среднее — ситуация, когда атомы приобретают устойчивость, делясь электронами (чтобы не возникало электрических зарядов), но при этом общее количество атомов, вовлеченных в этот процесс, было бы небольшим, чтобы в результате образовывались только очень маленькие молекулы. Внутри молекул силы притяжения могут быть весьма значительными, в результате чего молекулы будут распадаться только при очень высоких температурах. А вот силы притяжения между молекулами будут слабыми.
Давайте рассмотрим атом водорода. Он имеет только один электрон. Два атома водорода объединяются вместе и пользуются ими совместно. Пока они остаются вместе, каждый может считать два электрона находящимися в своей внешней оболочке и будет иметь стабильную конфигурацию атома гелия. У них больше нет в запасе электронов, чтобы отдавать в совместное пользование с другими соседями. Поэтому образование молекулы на этом завершится. Молекула водорода состоит только из двух атомов (H2).
Сила притяжения между атомами в молекуле велика, поэтому, чтобы разбить ее на атомы, понадобится температура более 2000 °C. Но между отдельными молекулами, каждая из которых после объединения двух атомов стала вполне самодостаточной, существует лишь слабое притяжение. Поэтому водород — Газ, но состоящий не из отдельных атомов (как в случае с инертными газами), а из двухатомных молекул.
Подобное происходит и с фтором (распределение электронов 2, 7), кислородом (2, 6), азотом (2, 5). Атом фтора может отдать электрон и образовать фонд совместного пользования из двух электронов с соседним атомом фтора, который также поделится электроном. Два атома кислорода могут внести вклад из двух электронов каждый и образовать совместный фонд из четырех электронов, а два атома азота могут отдать каждый по три электрона и совместно пользоваться шестью электронами.
Во всех случаях атомы достигнут распределения электронов 2, 8 (как у атома неона) ценой образования молекул. В итоге достигается достаточная устойчивость; F2, O2, и N2 являются Газами.
Атом кислорода может также образовывать совместный фонд из двух электронов с двумя соседями, которые также могут образовать такой же фонд из двух электронов между собой. Результатом явится комбинация трех атомов кислорода (O3), каждый из которых имеет устойчивую конфигурацию неона. Комбинация O3 называется озоном. Это тоже Газ.
Кислород, азот и фтор могут образовывать также смешанные молекулы. К примеру, комбинация атомов азота и кислорода даст необходимую стабильность для каждого из них. Атом азота также может делиться электронами с каждым из трех атомов фтора, а атом кислорода — с двумя. В результате получается NO, NF3 и OF2. Все они являются Газами.
Атомы, сами по себе не образующие Газы, могут сделать это в комбинации с водородом, кислородом, фтором или азотом. К примеру, два атома хлора (распределение электронов 2, 8, 7), объединяясь в молекулу, пользуются двумя электронами совместно, и оба приобретают конфигурацию аргона 2, 8, 8. Cl2, — это газ даже при комнатной температуре, однако межмолекулярное притяжение в нем достаточно велико и не дает ему стать Газом. Однако, если атом хлора поделится электроном с атомом фтора, получится фторид хлора (ClF), являющийся Газом.
Атом бора (2, 3) может образовывать совместный фонд из двух электронов с каждым из трех атомов фтора, а атом углерода — с каждым из четырех атомов фтора. Получившиеся в результате соединения — BF3 и CF4 — Газы.
Атом углерода может вступить в совместное пользование двумя электронами с каждым из четырех атомов водорода или четырьмя электронами с атомом кислорода. Получившиеся в результате метан CH4 и окись углерода CO — газы. Комбинация из двух атомов углерода (четырьмя электронами они владеют совместно) могут начать совместное пользование двумя электронами с каждым из четырех атомов водорода, атом кремния — соответственно двумя электронами с каждым из четырех атомов водорода. Получившиеся в результате этилен (C2H2) и силан (SiH4) — Газы.
Всего я могу назвать 20 Газов, которые можно разделить следующим образом.
1) Пять элементов, состоящих из одиночных атомов: гелий, неон, аргон, криптон и ксенон.
2) Четыре элемента, состоящие из двухатомных молекул: кислород, азот, водород, фтор.
3) Один элемент, имеющий трехатомную молекулу, — озон.
4) Десять веществ, молекулы которых состоят из различных элементов, по крайней мере один из них входит в категорию 2.
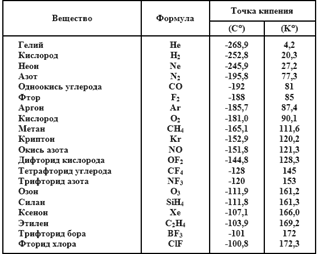
В приведенной далее таблице перечислены 20 газов в порядке повышения точки кипения, а температура кипения дана как по шкале Цельсия, так и по шкале Кельвина.
Пять инертных газов разбросаны среди других Газов. Кстати, два из трех Газов, имеющих самую низкую точку кипения, — это гелий и неон. Аргон в списке идет седьмым, криптон — десятым, а ксенон — семнадцатым. Поэтому, наверное, не стоило бы удивляться, если бы все Газы были также инертными.
Двадцать газов
Вероятно, так бы и было, если бы образующие их молекулы обладали устойчивостью, не распадались на атомы. Но дело в том, что все молекулы при определенных условиях могут распадаться на атомы, а свободные атомы (особенно фтора и кислорода) обладают высокой активностью.
В Газах это не проявляется. Что будет, если молекула фтора распадется на два атома фтора? Они окажутся в окружении одинаковых двухатомных молекул фтора, и единственным возможным результатом будет повторное воссоединение атомов в молекулу. Если же в составе газа присутствуют и другие молекулы, возможно образование другой молекулярной комбинации, обладающей большей устойчивостью, чем F2, то есть химическая реакция.
Молекула фтора действительно имеет тенденцию к распаду даже при обычных температурах, и этого достаточно. Свободные атомы фтора будут атаковать все вокруг, что фтором не является, в результате химической реакции повысится температура, что вызовет еще более интенсивное расщепление молекул фтора и т. д. Таким образом, молекулы фтора обладают высокой химической активностью, им мало в чем уступают фторид хлора и озон. Эти вещества самые активные из всех Газов.
Молекулы кислорода расщепляются тяжелее и остаются невредимыми (и инертными) в условиях, когда фтор уже проявляет активность. Вы можете возразить, что кислород является очень активным элементом, однако это верно лишь при высоких температурах, где на разрыв молекул можно потратить больше энергии. К тому же не забывайте, что мы живем в море свободного кислорода без вреда для себя. Неживые вещества — такие, как бумага, дерево, уголь или керосин, считающиеся очень горючими, — могут неопределенно долго купаться в кислороде, причем химическая реакция так и не начнется. Для ее начала существует одно непременное условие — повышение температуры.
При нагреве кислород становится активным, легко вступает во взаимодействие с другими Газами: водородом, окисью углерода и метаном.
Молекулы азота разрываются еще труднее. До открытия группы инертных газов азот считался инертным (за неимением конкурентов). Он, а также тетрафторид углерода являются двумя Газами в списке (кроме группы инертных), сохраняющими большую степень инертности. Однако и их молекулы можно разрушить.
Жизнь зависит от того, что некая бактерия может расщепить молекулу азота. Человек, научившись делать то же самое в большем масштабе, создал важные технологические процессы. Когда молекула азота разрушается, отдельные атомы азота становятся активными и начинают вступать в химические реакции. Это один из самых распространенных элементов, чрезвычайно важный для существования живой материи.
В инертных газах все происходит по-другому. В них нет молекул, которые можно расщеплять. Мы имеем дело со стабильными атомами, и возникновение их комбинаций с другими атомами для достижения большей устойчивости представляется маловероятным. Первоначально делались безуспешные попытки заставить инертные газы вступать в химические реакции, после чего химики удовлетворились тем, что сумели объяснить этот факт с научной точки зрения.
По правде говоря, периодически попытки возобновлялись, но успеха все равно не принесли. Вплоть до 1962 года единственное, чего удалось добиться химикам, желающим связать атомы инертных газов с другими атомами, — это создать «решетчатые» структуры. В них составляющие молекулу атомы образуют ряд «клеток», в который иногда в процессе формирования «клеток» может попасть посторонний атом, даже атом инертного газа. Тогда инертный газ оказывается частью молекулы и не может освободиться, пока не разрушена молекула. Однако такое объединение оказывается чисто физическим. Химические связи при этом не образуются.
Давайте продолжим рассуждения. Точка кипения гелия — это 4, 2° K, неона — 27, 2° K, аргона — 87, 4° K, криптона — 120, 2° K, ксенона — 160, 8° K. Точка кипения радона — шестого и последнего из группы инертных газов, имеющего самый массивный атом, — 213° K (-61, 8 °C). Радон даже не является Газом. Он только газ.
Далее: с ростом массы атома инертного газа уменьшается его ионизационный потенциал (величина, определяющая легкость, с которой электрон может быть оторван от атома). Одновременное повышение точки кипения и уменьшение ионизационного потенциала означает, что инертный газ становится менее инертным с ростом атомной массы.
Тогда получается, что радон должен быть наименее инертным из группы инертных газов, а значит, существует вероятность заставить его вступить в химическую реакцию. Во всяком случае, эта вероятность выше, чем с остальными инертными газами. Однако радон является радиоактивным элементом с периодом полураспада, равным менее 4 суток. Поэтому он встречается очень редко, и с ним можно работать только в специальных условиях. Следующий, наиболее близкий к нему по свойствам элемент — ксенон. Он также встречается крайне редко, но по крайней мере является доступным и стабильным.
Но если можно ожидать, что ксенон вступит в химическую реакцию, то с какими именно атомами? Было бы естественно предположить, что для этого следует выбрать наиболее химически активный элемент — фтор или фторсодержащие вещества. Если ксенон не вступит в реакцию с ними, он не станет реагировать ни с чем.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|