
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
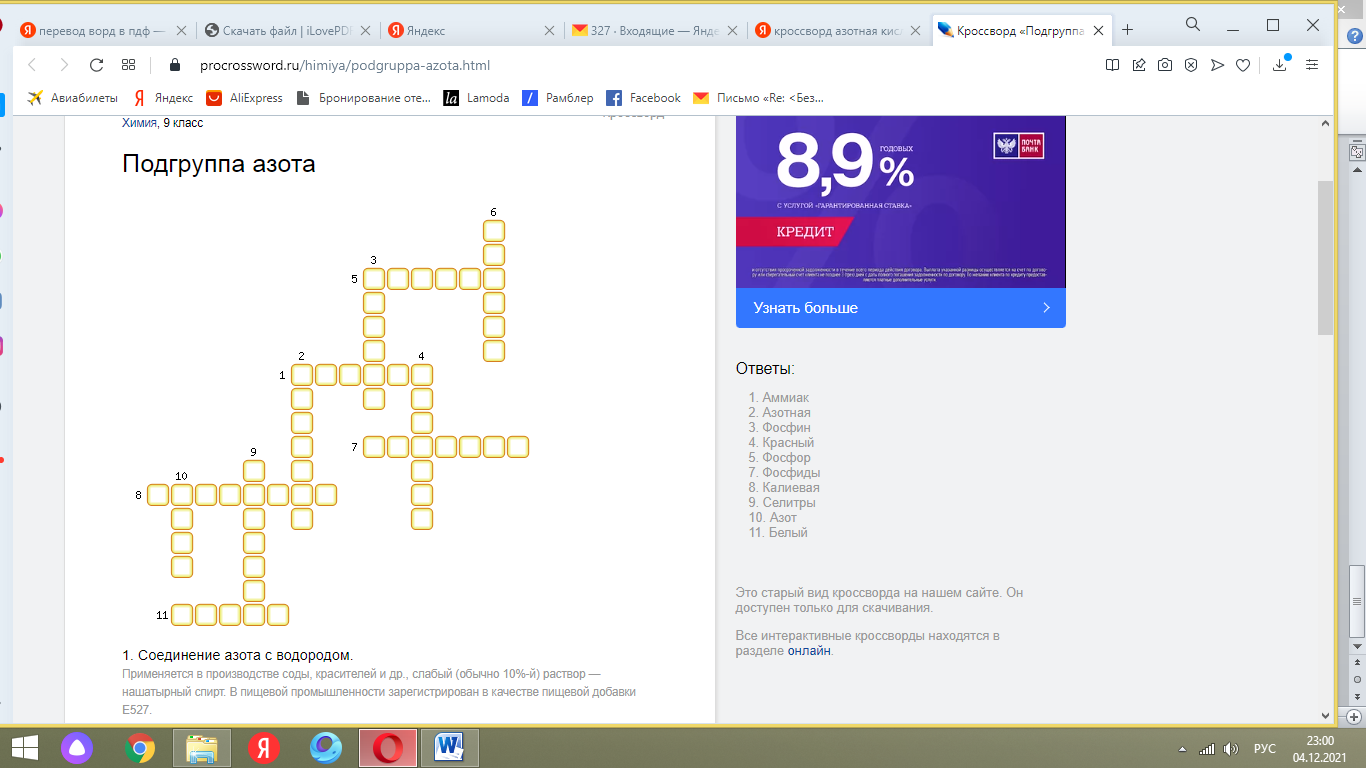
Подгруппа азота
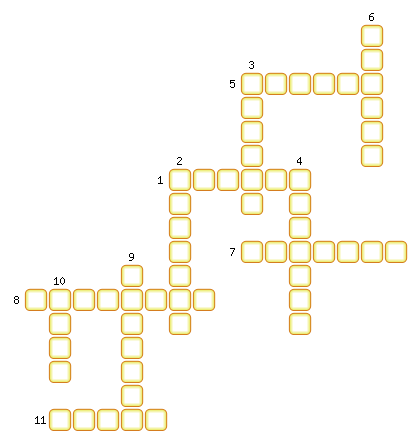
1. Соединение азота с водородом.
Применяется в производстве соды, красителей и др., слабый (обычно 10%-й) раствор — нашатырный спирт. В пищевой промышленности зарегистрирован в качестве пищевой добавки E527.
2. Сильная одноосновная кислота с едким запахом; гигроскопична, «дымит».
Эта кислота является одним из самых крупнотоннажных продуктов химической промышленности. Её пары очень вредны: вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное желтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного вещества – NO2 (газа бурого цвета).
3. Очень ядовитый газ с запахом чеснока.
Небольшие примеси этого газа заставляют его самопроизвольно воспламеняться. Чистый Ф. находит применение в легировании полупроводников.
4. Одна из аллотрофных модификаций фосфора. Это порошок красно-бурого цвета. Не растворяется в воде, не огнеопасен.
Ядовитость его меньше, поэтому он применяется гораздо шире, например, в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение. Это основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
5. Элемент главной подгруппы V группы, имеющий атомную массу 30, 974.
Этот элемент входит в состав нуклеотидов, нуклеиновых кислот, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3•Ca(OH)2. Входит состав зубной эмали. Основную роль в превращениях этого соединения в организме человека и животных играет печень. Обмен его соединений регулируется гормонами и витамином D. Суточная потребность человека составляет 800—1500 мг. При недостатке в организме развиваются различные заболевания костей.
6. Одна из аллотрофных модификаций фосфора. Образуется из белого фосфора при нагревании до 200-220º С и высоком давлении.
Впервые эта модификация фосфора была получена в 1914 году американским физиком П. У. Бриджменом. Это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Проводит электрический ток и имеет свойства полупроводника.
7. Соединения фосфора с металлами.
Наибольшее значение имеет применение ряда Ф. (InP, GaP) в качестве полупроводниковых материалов. Ф. цинка используется как яд для борьбы с грызунами. Ф. вводят в состав некоторых цветных сплавов, для раскисления и улучшения антифрикционных свойств. Склонность некоторых Ф. разлагаться с выделением самовоспламеняющихся на воздухе фосфинов используется в пиротехнике для приготовления сигнальных средств.
8. Селитра являющаяся составной частью чёрного пороха.
В древности для получения этого нитрата служили селитряницы — кучи из смеси навоза с известняком, строительным мусором и т. п. с прослойками из соломы или хвороста. При гниении навоза образовывался аммиак, который в процессе нитрификации превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия. Такой способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции: KCl + NaNO3 = KNO3 + NaCI.
9. Соли азотной кислоты – нитраты натрия, калия, аммония, кальция.
Они используются как азотные удобрения, при этом калиевая является также источником необходимого растениям калия. Аммонийная – используется для приготовления таких взрывчатых веществ как аммонал и аммотол. Растение использует азот из соли для построения клеток организма, создания хлорофилла. Для людей нитраты неядовиты, но в организме превращаются в нитриты.
10. Этот газ является главной составной частью воздуха. Газ: без цвета, запаха и вкуса, легче воздуха. Сжижаясь, превращается в снегообразную массу.
Этот газ является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18% по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов содержится около 2%, по массовой доле — около 2, 5% (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного газа содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. В результате процессов гниения и разложения органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие этот газ.
11. Фосфор, получающийся в твёрдом состоянии при быстром охлаждении паров фосфора. В чистом виде он бесцветен и прозрачен. Одна из аллотрофных модификаций фосфора.
Этот фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза этого фосфора для взрослого мужчины составляет 0, 05—0, 1 г. Попадая на кожу, даёт тяжелые ожоги.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|