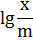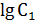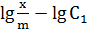- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа №5. Определение адсорбционной способности уксусной кислоты. Теоретическая часть. Ход работы. Контрольные вопросы
|
Лабораторная работа №5 Определение адсорбционной способности уксусной кислоты Цель: экспериментально определить концентрацию растворов уксусной кислоты до и после адсорбции, построить кривую зависимости адсорбции от равновесной концентрации раствора (изотерму адсорбции), рассчитать константы в уравнении Фрейндлиха. Т. Б. Соблюдать осторожность при работе с кислотой и щёлочью. Приборы и реактивы: конические колбы на 200 м3, 8шт.; колбы плоскодонные на 200 м3, 6 шт. ; стаканы химические на 100 м3, 6 шт.; бюретка на 50 см3, 2 шт.; воронки, 6 шт.; фенолфталеин; раствор уксусной кислоты 0, 5 М.; раствор щелочи NaOH 0, 1 М.; пипетки на 5, 10 и 50 см3; мерные цилиндры на 100 и 25 см3; фильтры; высушенная глина; весы с разновесами; часовое стекло.
Теоретическая часть Адсорбция на границе твердое тело – раствор в общем похожа на адсорбцию газа на поверхности твердого тела. Но в данном случае явление адсорбции сильно усложняется наличием третьего компонента – растворителя. Молекулы растворителя тоже могут адсорбироваться на поверхности адсорбента и, следовательно, могут составлять конкуренцию молекулам адсорбтива. Кроме того, адсорбция на границе твердое тело – раствор усложняетсявзаимодействием молекул адсорбтива с молекулами растворителя. Адсорбционная способность зависит от природы растворителя, адсорбента и адсорбтива, температуры и концентрации. Критерием адсорбируемости вещества (растворителя или растворенного вещества) на поверхности твердого тела может быть его поверхностноенатяжение. Как известно, ПАВ обладают малым поверхностным натяжением. Поэтому, чем больше поверхностное натяжение самой среды (растворителя), тем меньше молекулы растворителя способны к адсорбции натвердом теле и тем лучше на нем адсорбируется растворенное вещество(ПАВ). Адсорбция ПАВ на поверхности твердого тела обычно хорошо идетиз водных растворов и много хуже из растворов органических растворителей, имеющих сравнительно малое собственное поверхностное натяжение. Другим критерием пригодности растворителя в качестве среды для адсорбции является теплота смачивания этим растворителем адсорбента. Чембольше теплота смачивания, тем больше энергетическое взаимодействие растворителя с адсорбентом и тем менее пригодной средой для адсорбции является данный растворитель. Таким образом, можно сформулировать общееправило: если взятый растворитель плохо смачивает твердую поверхностьадсорбента, то адсорбция растворенного вещества из такого растворителя будет велика. Твердые вещества, состоящие из полярных молекул (алюмосиликаты) дают большой тепловой эффект при смачивании полярными растворителями(водой). Вещества, состоящие из неполярных частиц (уголь), выделяютбольше тепла при смачивании неполярными жидкостями (углеводородами). Твердые вещества, состоящие из полярных молекул (алюмосиликаты) дают большой тепловой эффект при смачивании полярными растворителями(водой). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Вещества, состоящие из неполярных частиц (уголь), выделяют больше тепла при смачивании неполярными жидкостями (углеводородами). частиц (уголь), выделяютбольше тепла при смачивании неполярными жидкостями (углеводородами). Неполярные адсорбенты, как правило, лучше адсорбируют неполярные адсорбтивы, а полярные адсорбенты – полярные адсорбтивы. Поскольку диэлектрическая проницаемость ε до некоторой степениявляется мерой полярности вещества, то существует связь ее с адсорбционной способностью в этих жидкостях различных адсорбтивов. Рассматриваявлияние химической природы адсорбтива на его способность адсорбироваться на поверхности твердого тела, можно руководствоваться правилом сформулированным П. А. Ребиндером: Следовательно, на границе вода (ε вода = 78, 3) – уголь (ε уголь≈ 1) будетидти адсорбция веществ, имеющих промежуточные значения диэлектрической постоянной, таких как уксусная кислота (ε уксус. к-та ≈ 6), бутиловый спирт(ε бутил. спирт≈ 18), анилин (ε анилин≈ 7) и ряда других. То есть должно соблюдаться условие: ε А > ε B > ε C или ε А < ε B < ε C . Количество адсорбированного вещества определяется избытком вещества на границе фаз по сравнению с равновесным количеством. Избыток вещества в молях, отнесенный к 1 см2 (или 1м2) поверхности – называют адсорбцией. Если поверхность адсорбента неизвестна (пористые твердые адсорбенты), количество адсорбированного вещества относят к 1 г (или 1 кг) адсорбента. Г =mC Co p − моль/г, На поверхности адсорбента выберем площадку размером 1 см2, на которой будут адсорбироватьсячастицы адсорбтива. Будем считать, что: а) поверхность адсорбента однородная, т. е. центры, на которые адсорбируются частицы, равномерно распределены по всей поверхности; б) адсорбированные частицы не взаимодействуют друг с другом.
Ход работы Из 0, 5 М раствора уксусной кислоты разбавлением водой в шести сухих пронумерованных конических колбах готовят по 100 см3 следующие растворы кислоты:
Полученный (100 мл) раствор делят на 2 части: 50мл каждого раствора отбирают в стакан для определения концентрации СН3СНООН до адсорбции, а во вторую часть вносят по 2 г сухой глины, закрывают колбы пробками и ставят на 20 минут периодически встряхивая. Пока устанавливается адсорбционное равновесие, определяют концентрации исходных растворов путем титрования 0, 1 М раствором щелочи NaOH, отбирая пипеткой до 5 мл исходных растворов из первых трёх проб и по 10 мл из последних трёх. Титрование проводят 2 – 3 раза и берут среднее значение. Затем в 6 сухих плоскодонных колб помещают воронки с сухими фильтрами – и фильтруют растворы после адсорбции.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Первые 3 – 5 мл раствора из каждой колбы, во избежание ошибок за счет адсорбции кислоты фильтрата, выливают. По окончании фильтрования отбирают растворы в таких же объемах, какие были взяты для титрования исходных растворов, и титруют тем же раствором щелочи. Результаты титрования заносят в таблицу
По данным титрования определяют содержание кислоты в молях/л до и после адсорбции глиной (С0 и С1). Для расчёта адсорбции Х1, Х2, Х3 определяют разность количество кислоты в миллимолях в 50 мл раствора до и после адсорбции по формуле: где: W – объём кислоты, взятой для адсорбции. Вычисляют для каждого из растворов величины удельной адсорбции
Все вычисления помещают в таблицу
Для проверки применимости формулы Фрейндлиха строят график в координатах
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Вывод: Подтвердить применимость уравнения Фрейндлиха для данной адсорбции. __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольные вопросы 1. Характеристика адсорбции, её особенности на твёрдых адсорбентах. 2. Факторы, влияющие нам адсорбцию. 3. Применимость уравнения Фрейндлиха и Лэнгмюра. 4. Определение концентрации кислоты путём прямого титрования методом нейтрализации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
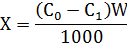
 и тд.
и тд.