
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вычисление ,необходимые для кристаллогидратов
Если для приготовления раствора используются кристаллогидраты (напр., медный купорос CuSO4× 5H2О или глауберова соль Na2SO4× 10H2О и так далее), тогда при приготовлении раствора необходимо учитывать воду, которая входит в состав кристаллогидрата.
Если m(kr) масса кристаллогидрата в граммах,
m(B) масса безводного компонента кристаллогидрата в граммах,
M(kr) молекулярная масса кристаллогидрата,
M(B) молекулярная масса безводного кристаллогидрата, тогда:
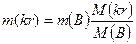 ;
; 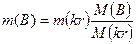
Задача. Ск. надо взять медного купороса, чтобы приготовить 500 г 16%
раствора сульфата меди CuSO4. M(kr) = 250, M(CuSO4) = 160.
Решение: для приготовления 500 г 16% раствора соли надо взять х(г) соли:
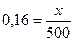 х = 80г.
х = 80г. 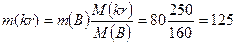 г. Ответ: 125 г.
г. Ответ: 125 г.
Задача. Какое количество медного купороса (CuSO4•5H2O) вступило в реакцию с едким натром, если при этом получено 0, 196 г гидроксида меди.
Решение: из уравнения реакции видно, что в осадок выпадает такое же количество гидроксида меди, как и количество медного купороса, которое вступило в реакцию: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4. 0, 196г Cu(OH)2 это 0, 196/98 = 0, 002 моля гидроксида меди, а это 0, 002× 250 = 0, 5г медного купороса.
При нормальных условиях (н. у. ) один моль газа занимает объем 22, 4 л.
Если масса газа m(г), и (н. у. ), газ занимает объем 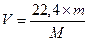 (литров).
(литров).
Плотность газа 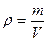 , m – масса газа, V – объем газа.
, m – масса газа, V – объем газа.
Нормальные условия (н. у. ) t = 0oC = 273К; P = 1 атм = 1, 01× 105 Па
Стандартные условия: t = 25oC = 298К, P = 1 атм.
Уравнение состояния газа: 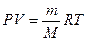 [P] – Па, [V] – м3, [m] – г,
[P] – Па, [V] – м3, [m] – г,
R = 8, 314, 1 м3 = 1000 л; 1 л = 1000 мл.
Задача. В 200 г воды растворили 50 л газа (н. у. ) HCl (36, 5). Вычислить
процентную концентрацию газа в растворе.
Решение: 50 л газа (н. у. ) это 50/22, 4 ≈ 2, 23 моля газа, а это 2, 23× 36, 5 = 81, 40 г
газа. 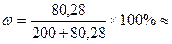 28, 6%.
28, 6%.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|