
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
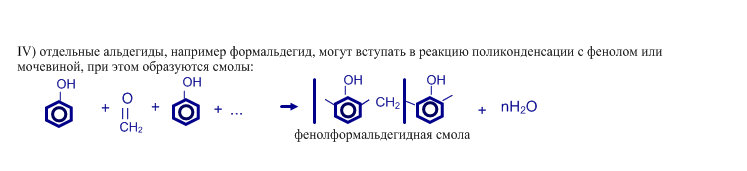
Получение альдегидов и кетонов
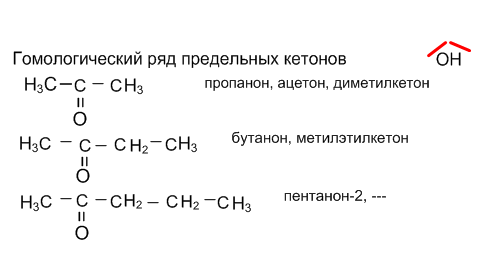
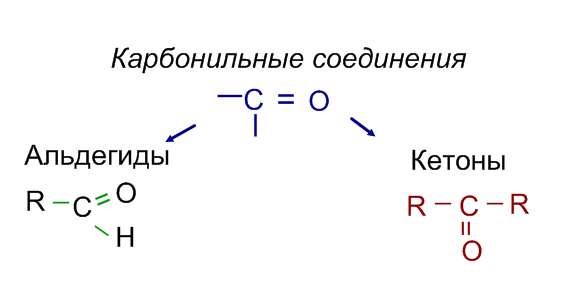
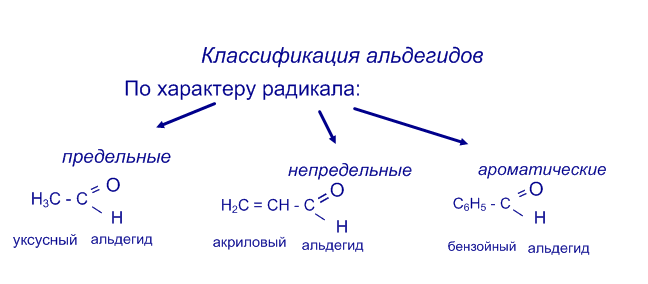

Систематические названия альдегидов складываются из названия УВ + суффикс –аль. Тривиальные названия альдегидов происходят от названия кислоты. в которую они окисляются.
Систематические названия кетонов складываются из названия УВ + суффикс –он
Физические свойства.
Формальдегид-газ, низшие альдегиды и кетоны С2 –С11 -бесцветные летучие жидкости с резким запахом; легкокипящие, первые хорошо растворимы в воде, с ростом радикала растворимость в воде падает. Жидкие альдегиды и кетоны легче воды. Все они горючи и ядовиты. Альдегиды и кетоны с числом С-атомов больше 12 –твёрдые вещества, нерастворимые в воде. Хорошо растворяются в органических растворителях. Поскольку в молекулах карбонильных соединений нет H-атомов, непосредственно связанных с О-атомом, они водородные связи не образуют, поэтому температуры
кипения и плавления карбонильных соединений значительно ниже чем у соответствующих спиртов. С ростом молекулярной массы температура кипения и плавления карбонильных соединений растёт. Разветвлённые альдегиды и кетоны имеют более высокую температуру кипения, чем их не разветвлённые изомеры. Температура кипения кетонов несколько выше, чем у изомерных альдегидов.
Акролеин имеет резкий удушливый запах, бензальдегид – запах горького миндаля.
Физические свойства и применение ацетона см. §29.

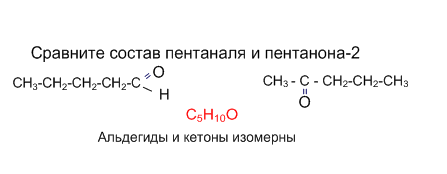 Изомерия и номенклатура. Составьте формулы изомеров состава С5Н10О, назовите их.
Изомерия и номенклатура. Составьте формулы изомеров состава С5Н10О, назовите их.
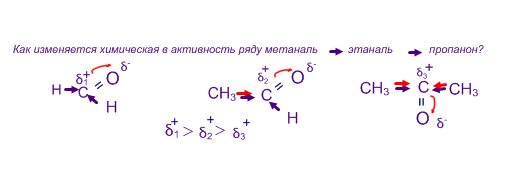
 .
.
. 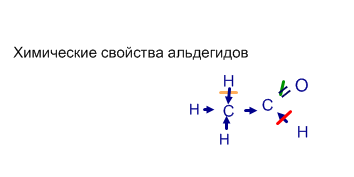
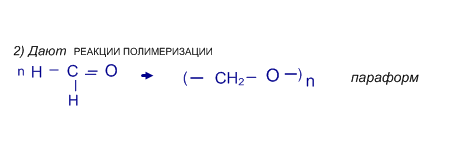
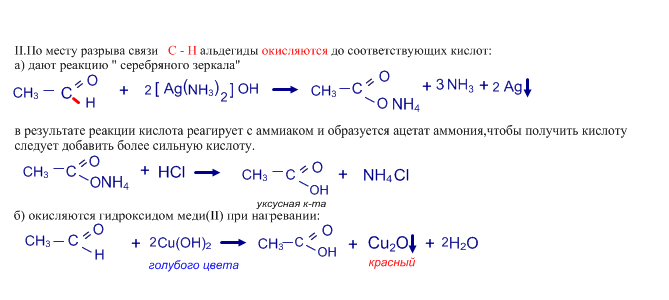
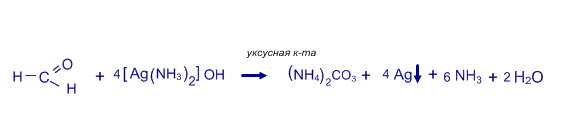
Качественные реакции на альдегиды: а) реакция " серебряного зеркала"
б) реакция с гидроксидом меди(II) при нагревании c образованием осадка красного цвета - Cu2O
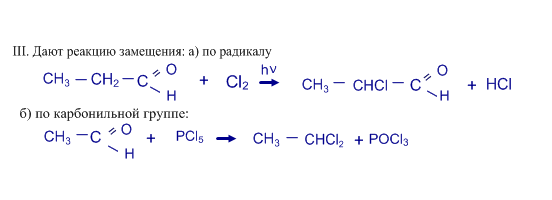
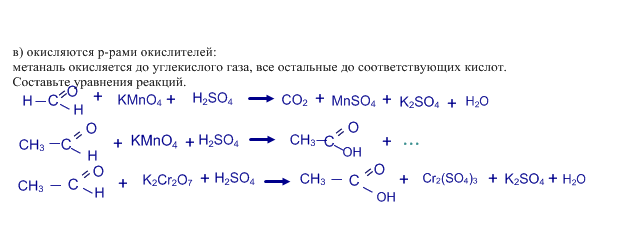

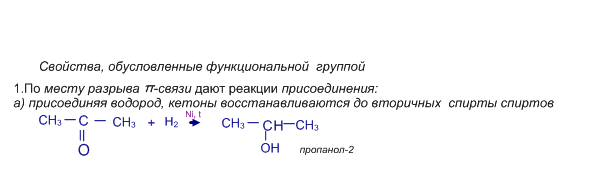
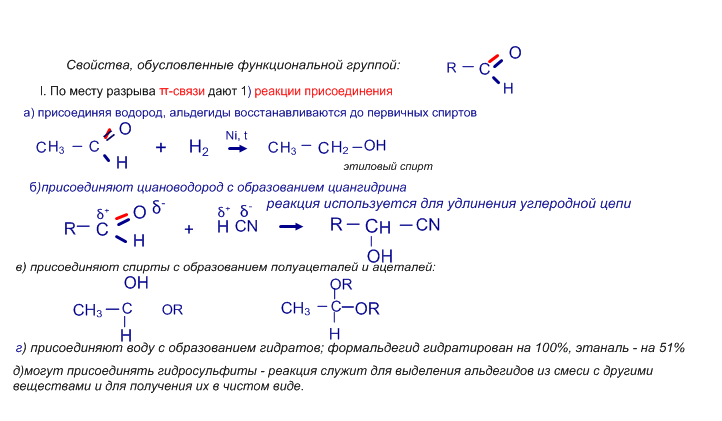
б) присоединяют циановодород HCN, в) гидросульфит натрия NaHSO3;
Однако, для кетонов не характерно присоединение спиртов, они практически не гидратируются.
Кетоны не способны к полимеризации, не дают качественные реакции на альдегиды.
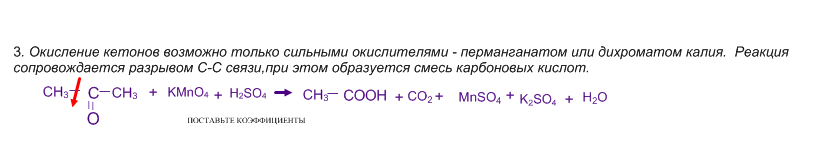
2. Качественная реакция на ацетон - взаимодействие с йодом в присутствии щёлочи при нагревании.
Реакция сопровождается образованием йодоформа - жёлтого вещества с характерным запахом.
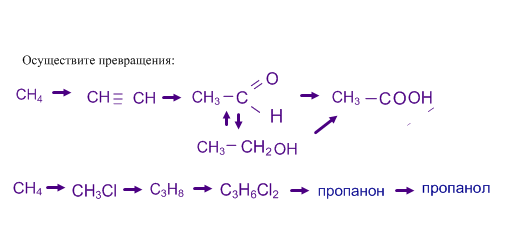
Получение альдегидов и кетонов
1. Гидратация алкинов: а) ацетилен + вода = ацетальальдегид;
б) гомологи + вода = кетоны.
2. Гидролиз дигалогенопроизводных ( + водный р-р щёлочи)
а) первичных дигалогенопроизводных = альдегиды;
CH3-CH2-CHCl2 + 2NaOH = CH3-CH2-COH + 2NaCl + H2O
пропаналь
б) вторичных дигалогенопроизводных = кетоны.
CH3-CCl2-CH3 + 2NaOH = CH3-CO-CH3 + 2NaCl + H2O
пропанон
3. Окисление спиртов (см. спирты)
+ CuO: первичные спирты = альдегиды;
вторичные спирты = кетоны.
4. Дегидрирование спиртов (см. спирты)
5. Окисление алкенов. При окислении этилена и пропилена кислородом воздуха в присутствии
CuCl2 и PdCl2 образуются соответственно уксусный альдегид и ацетон
CH2 = CH2 + O2 = CH3-CH=O (уксусный альдегид)
CH2 = CH -CH3 + O2 = CH3-CO -CH3 (ацетон)
Кетоны получают прокаливанием кальциевых и бариевых солей карбоновых кислот
(R-COO)2 Ca = R- CO - R + CaCO3
Специфические способы.
1. Получение формальдегида каталитическим окислением четана:
Mn2+/ Cu2+ t
CH4 + O2 = H2C=O + H2O
2. Кумольный способ получения ацетона (см. фенол)
§ 26-29 УПР. 6-7 СХЕМА 4 К §29
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|