
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
Конец формы
Начало формы
Концентрация – это величина, измеряемая количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
Наиболее часто применяемые способы выражения концентрации:
· массовая доля или процентная концентрация (ω, %)
· молярная концентрацияили молярность (М или См, м)
· молярная концентрация эквивалента или нормальность (N, или Сн, н)
· титр, (Т, г/мл)
· моляльность,
· молярная доля,
· объемная доля,
1. Способы выражения концентрации растворов
1. 1 Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
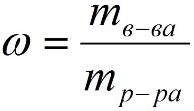 , где: (1)
, где: (1)
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя.
Массовую долю выражают в долях от нуля до единицы или в процентах.
1. 2 Молярная концентрация или молярность (М или См, м) – это количество молей растворённого вещества в одном литре раствора:
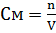 , где: (2)
, где: (2)
Cм – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют:
1м - молярный или одномолярный, если в 1 литре раствора растворено 1 моль вещества,
т. е в 1литре 1 молярного раствора содержится 1г-моль растворенного вещества
записываем так:
| 1л -1м р-ра → 1 г-моль в-ва |
(3)
0, 1м – децимолярный раствор;
0, 2м – 2-х децимолярный раствор;
0, 01м – сантимолярный раствор;
0, 001м – миллимолярный раствор.
1. 3 Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) (N, или Сн, н) – число грамм-эквивалентов данного вещества в одном литре раствора.
| 1л -1н р-ра → 1 г-экв в-ва |
(4)
Грамм-эквивалент вещества (Э) – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0, 1 моль-экв/л, называют децинормальным:
N = 0, 1 н.
1 н - нормальный или однонормальный
0, 1 н – децинормальный раствор;
0, 5 н – 5-ти децинормальный раствор или полунормальный;
0, 02 н – 2-х сантинормальный раствор;
0, 001 н – миллинормальный раствор.
1. 4 Титр (Т, г/мл)– содержание вещества в граммах в 1 мл раствора:
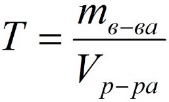 , где: (5)
, где: (5)
T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
Vр-ра – объём раствора, мл.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|