
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основные понятия и законы химии
Основные понятия и законы химии
Тема: Определение молекулярной массы.
Молекуля́ рная ма́ сса (менее правильный термин: молекулярный вес) — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. Однако следует чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и различаются по размерности.
Молекулярные массы сложных молекул можно определить, просто складывая относительные атомные массы входящих в них элементов. Например, молекулярная масса воды (H2O):
MrH2O = 2 ArH + ArO ≈ 2·1+16 = 18 а. е. м.
Mr-молекулярная масса; Ar-атомная масса.
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Например, молярная масса воды (H2O) есть M(H2O) = 2 M(H) +M(O) = 2·1+16 = 18 (г/моль). Стоит отметить, что, например, молярная масса кислорода как элемента = 16 (г/моль), а вещества — (O2) = 32 (г/моль). .
Примеры:
1. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора.
Решение.
Аг(Аl) = 27,
Аг(Сl) = 35, 5,
2. Вычислите относительную молекулярную массу карбоната кальция, имеющего формулу CaCO3
Решение:
Относительные молекулярные массы кальция, углерода и кислорода соответственно равны 40, 12 и 16. Учитывая, что молекула карбоната кальция состоит из одного атома кальция, одного атома углерода и трех атомов кислорода, найдем сумму их относительных атомных масс.

3. Вычислите относительную молекулярную массу сульфата алюминия, формула которого
Al2 (SO4)3.
Решение:
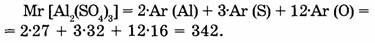
Указание по выполнению работы: Выполнить задания, аналогично приведенным примерам.
Задание. Пользуясь периодической системой химических элементов Д. И. Менделеева, вычислите:
1. Относительные атомные массы натрия, кислорода, азота, фтора, кремния.
2. Молекулярные массы Mg(NO3)2, CuOHCl, Fe2 (SO4)3 , H3PO4.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|