
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→ N-3 – окислитель, восстанавливается
1. Разлагается на свету и при нагревании
4HNO3 =t˚ C= 2H2O + 4NO2 + O2
образуется бурый газ - NO2
2. Окрашивает белки в оранжево-желтый цвет
(при попадании на кожу рук - " ксантопротеиновая реакция" )
3. Реагирует с металлами
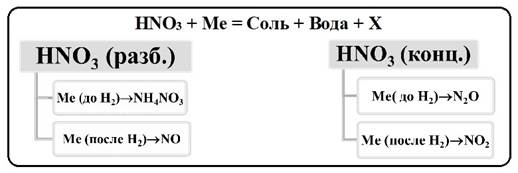
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
HNO3 + Me = Соль-Нитрат + H2O + Х
Запомните! При взаимодействии с металлами никогда не выделяется водород.
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже. Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.
Схема «Продукты взаимодействия азотной кислоты с металлами»

4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
4Zn + 10HNO3 (раствор горячий) =t˚ C= 4Zn(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 (оч. разб. горячий) =t˚ C= 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 4HNO3 (конц. горячий) =t˚ C= Zn(NO3)2 + 2NO2 + 2H2O
Холодная концентрированная азотная кислота не реагирует с Al, Cr, Fe – происходит пассивация, а при нагревании образуется NO2.
Fe + 4HNO3 (конц. ) холод≠ пассивация
6HNO3(конц. ) + Fe =t˚ C= 3H2O + 3NO2 + Fe(NO3)3
Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|