
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ХИМИЯ 8 класс 15.04. Тема «Решение задач на растворы». В реанимацию попадают больные, потерявшие много крови. В этих случаях используют 0,9%-й раствор поваренной соли (плотность = 1г/мл), который называется физиологическим раствором.. Представьте, что вы
ХИМИЯ 8 класс 15. 04
Тема «Решение задач на растворы»
1. Введение в тему урока
В медицине широко используется так называемый физиологический раствор – 0, 9%й раствор обыкновенной поваренной соли.
Его применяют в качестве заменителя плазмы крови при травмах и внутривенных вливаниях лекарств. (Поваренная соль входит в тканевые жидкости и в состав крови, где ее концентрация составляет около 0, 5%).
В реанимацию попадают больные, потерявшие много крови. В этих случаях используют 0, 9%-й раствор поваренной соли (плотность = 1г/мл), который называется физиологическим раствором.
Задача 1 .
Представьте, что вы медсестра реанимационного отделения и должны срочно приготовить 800 мл такого раствора. Как вы на месте медсестры приготовили бы такой раствор?
Решите двумя способами: как математики и как химики
Математически - р 800мл – 100%
Соль х мл – 0, 9%.
Запишем и решим пропорцию: ;
Химически -
Дано:
Vр-ра(NaCl)=800 мл;
Ѡ (NaCl)=0, 9%=0, 009
-----------------------------------
Найти: mNaCl=?, mводы=?.
Решение:
1. Что такое раствор? ( Однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. )
2. Примеры растворов, с которыми вы встречаетесь в быту. (Уксус, нашатырный спирт, перекись водорода, лекарственные настойки. )
3. Вещество чаще всего используют в качестве растворителя? (Вода. )
Часто понятие «раствор» мы связываем, прежде всего, с водой. Есть и другие растворы, например, спиртовой раствор йода, лекарственные настойки. Хотя именно вода является самым распространённым «растворителем» в природе. 75% поверхности Земли покрыто водой, человек на 70% состоит из воды.
Введём обозначения для решения задач: w- массовая доля растворённого вещества, 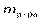 - масса раствора,
- масса раствора, 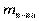 - масса растворённого вещества,
- масса растворённого вещества, 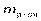 - масса растворителя (воды).
- масса растворителя (воды).
4. Что такое массовая доля растворённого вещества? (Отношение массы растворённого вещества к общей массе раствора. )
5. Вспомните формулу для вычисления массовой доли вещества и производные от неё. ( 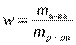 ,
, 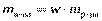 ,
, 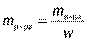 )
)
6. По какой формуле можно рассчитать массу раствора? ( 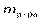 =
= 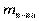 +
+ 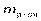 )
)
Решим такую задачу.
Задача. 1 Смешали 20 г 15%-го раствора кислоты и 50 г 8%-го раствора кислоты. Какова концентрация кислоты в образовавшемся растворе?
Решение
Дано:
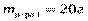
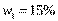
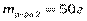
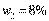
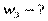
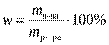
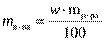
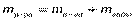
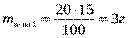
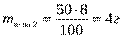
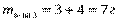
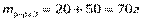
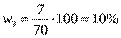
Ответ: 10%
ЗАДАЧА. 2. Какая масса растворенного вещества и какая масса воды содержится в 4 кг 10 % раствора ортофосфорной кислоты?
Дано: m(р-ра) = 4 кг Найти: m (в-ва)
ω (в-ва) = 10% или 0, 1 m (Н2О)
Решение:
m (в-ва) = ω (в-ва) · m(р-ра)
1) найдем массу вещества:
m (в-ва) = 0, 1 · 4 = 0, 4 (кг)
2) Найдем массу воды: m (Н2О) = m(р-ра) - m (в-ва)
m (Н2О) = 4 -0, 4 = 0, 6 (кг)
Ответ: m (в-ва) = 0, 4 кг,
m (Н2О) = 0, 6 кг
Домашнее задание:
1. Какую массу поваренной соли нужно взять для приготовления 500г раствора соли с массовой долей соли 15%?
2. Смешали 40 г 15%-го раствора соли и 50 г 60%-го раствора соли. Какова концентрация соли в образовавшемся растворе?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|