
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Изучение нового материала. 1. Макроскопические параметры. Идеальный газ.
Тема: Идеальный газ. Основное уравнение МКТ
Задачи урока:
1. сформировать представление о структуре и содержании новой физической теории;
2. организовать усвоение основных положений МКТ;
3. формирование умений описывать тепловые явления на молекулярно кинетических представлениях о строении вещества;
4. формировать мотивацию постановкой проблем и познавательных задач, раскрытием связи опыта и теории;
5. формировать умение анализировать факты при наблюдении явлений;
6. способствовать воспитанию познавательного интереса к физике, материалистического мировоззрения учащихся.
Организационный момент урока.
Постановка цели урока. Мы с вами продолжаем изучение основ молекулярно- кинетической теории. На предыдущем уроке мы рассмотрели основные положения МКТ. Сегодня на уроке необходимо на основе МКТ установить количественную зависимость давления газа от массы одной молекулы и среднего квадрата скорости ее движения. Поэтому тема урока: «Идеальный газ. Основное уравнение МКТ» Актуализация знаний.
1. Что такое молекулярно-кинетическая теория? Сформулируйте ее основные положения.
2. Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
3. Что называют броуновским движением? Каковы его особенности?
4. О чем свидетельствует броуновское движение?
5. Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
6. От чего зависит скорость диффузии? О чем свидетельствует явление диффузии?
Изучение нового материала. 1. Макроскопические параметры. Идеальный газ.
Состояние газа (так же как жидкости и твердого тела) может быть описано и без рассмотрения молекулярного строения вещества. Это делают с помощью макроскопических величин, совокупность которых однозначно определяет состояние системы. Такие величины называют параметрами состояния (или термодинамическими параметрами). Параметрами состояния любой системы являются ее объем, давление и температура. Если в каком-либо процессе изменяется хотя бы один из параметров состояния системы, то и само состояние системы становится другим.
Величины, характеризующие состояние макроскопических тел без учета их внутреннего строения называются макроскопическими параметрами.
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
1. Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
2. Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
3. Молекулы находятся в непрекращающемся хаотическом движении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя.
При высоких давлениях и низких температурах газ не может считаться идеальным. Такой газ называют реальным. (Поведение реального газа описывается законами, отличающимися от законов идеального газа. )
2. Давление газа. Основное уравнение МКТ газа.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м2 действует сила давления в 1 Н, называется Паскалем.
1мм. рт. ст. = 133 Па
10ž 1атм = 15 Па
Одной из основных задач молекулярно-кинетической теории газа является установление количественных соотношений между макроскопическими параметрами, характеризующими состояние газа (давлением, температурой), и величинами, характеризующими хаотическое тепловое движение молекул газа (скоростью молекул, их кинетической энергией). Одним из таких соотношений является зависимость между давлением идеального газа и средней кинетической энергией поступательного движения его молекул. Эту зависимость называют основным уравнением молекулярно-кинетической теории идеального газа:
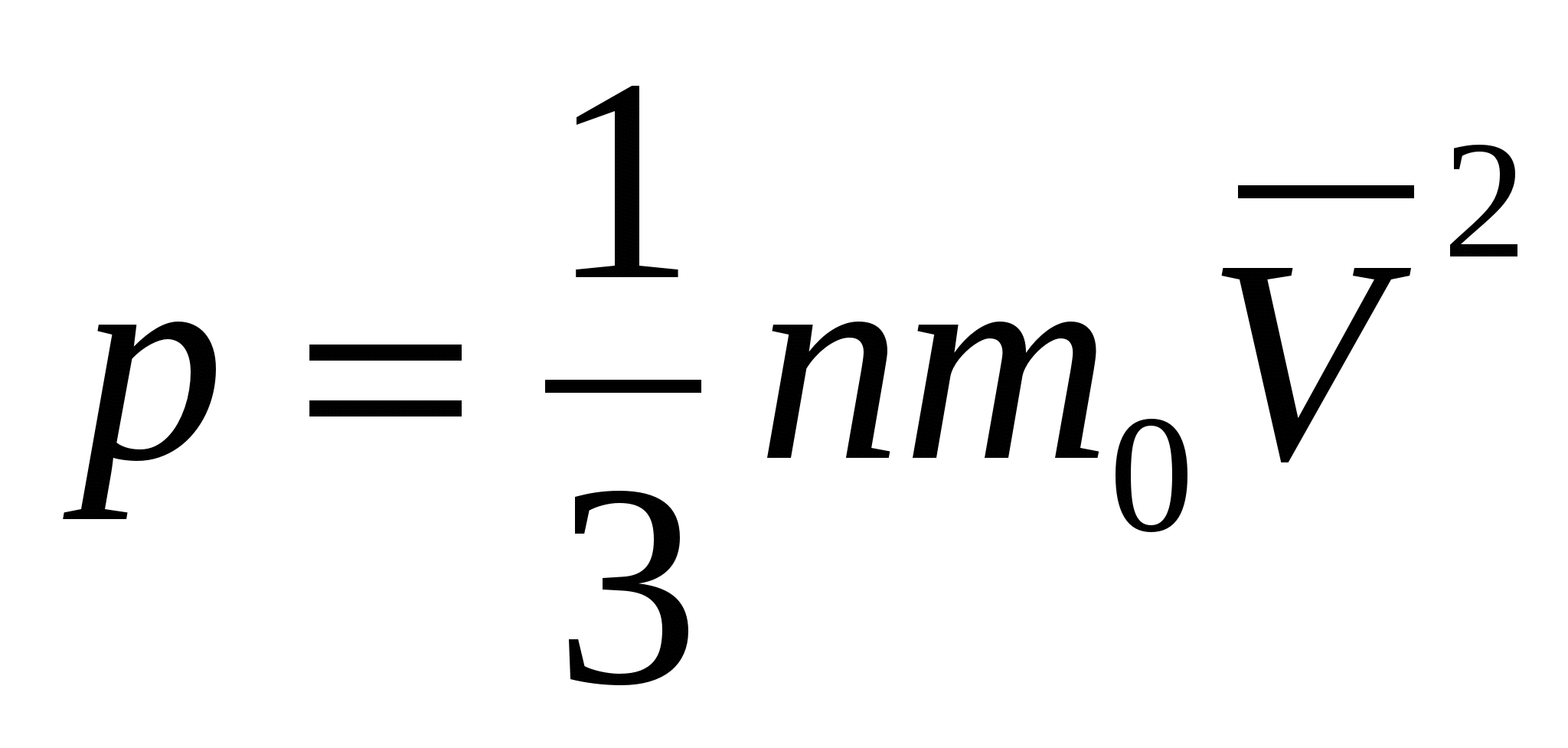 или
или 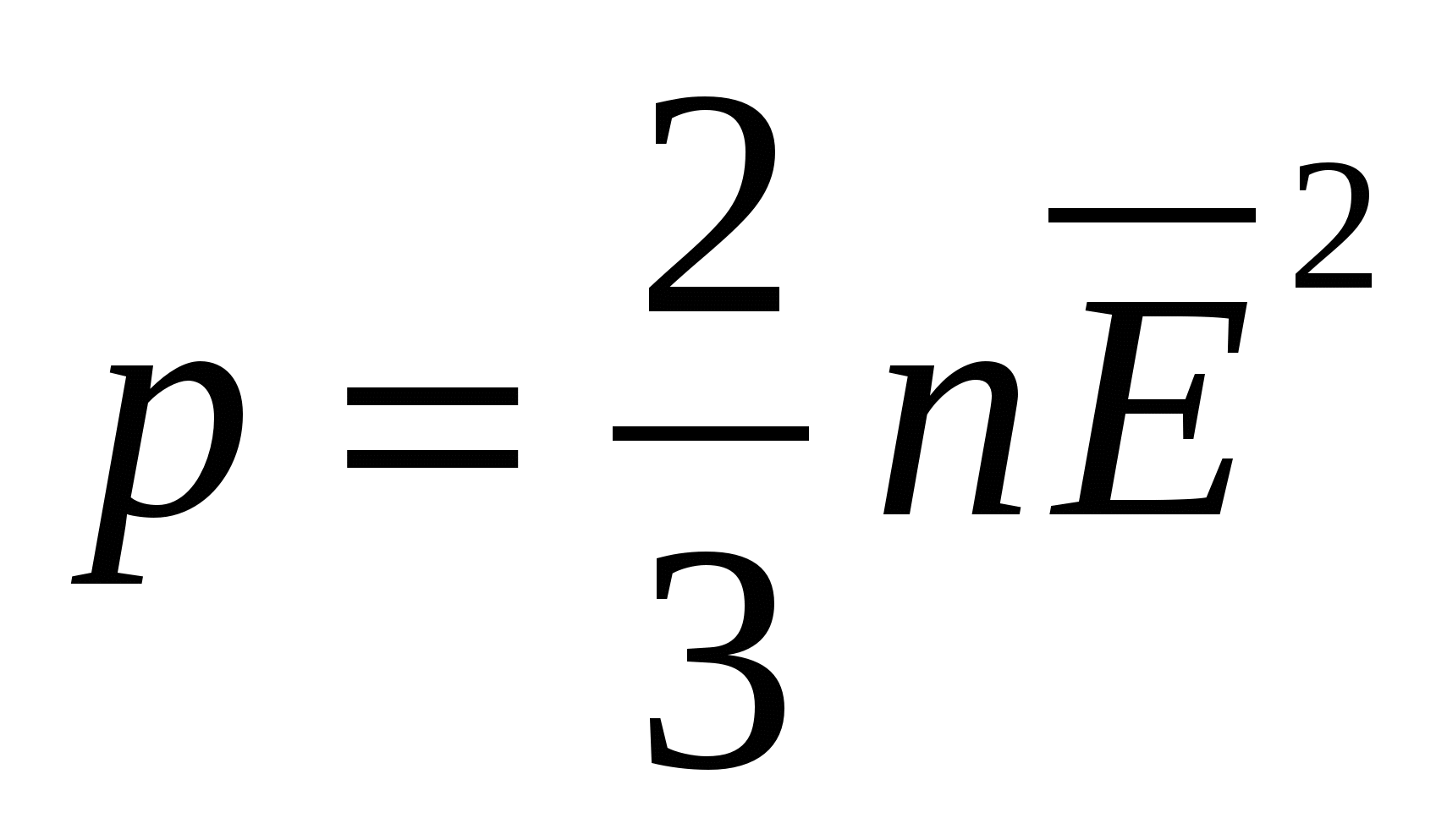
где р — давление газа; n — концентрация молекул газа (число его молекул в единичном объеме): m0 — масса молекулы газа, 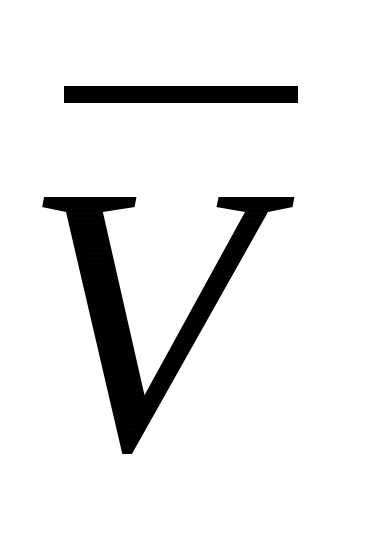 — средняя квадратичная скорость движения газовых молекул;
— средняя квадратичная скорость движения газовых молекул; 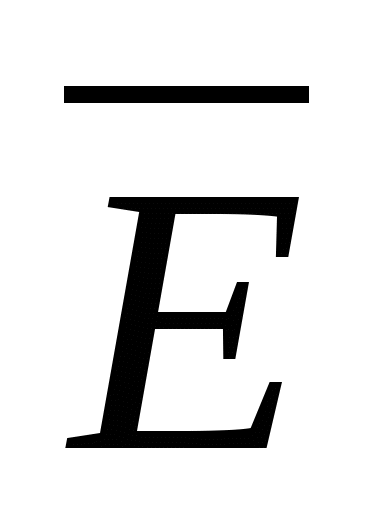 —средняя квадратичная энергия поступательного движения молекул идеального газа.
—средняя квадратичная энергия поступательного движения молекул идеального газа.
Давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул и концентрации молекул.
Это давление тем больше, чем больше средняя кинетическая энергия поступательного движения молекул.
Средней квадратической скоростью называют величину, равную корню квадратному из среднего арифметического значения квадратов скоростей N молекул газа:
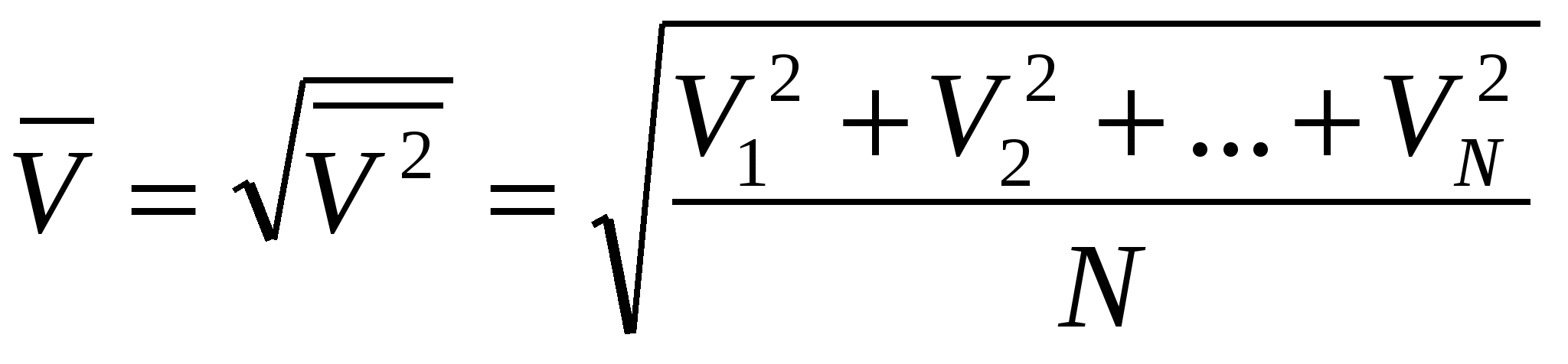
Средней кинетической энергией поступательного движения молекул идеального газа называют величину
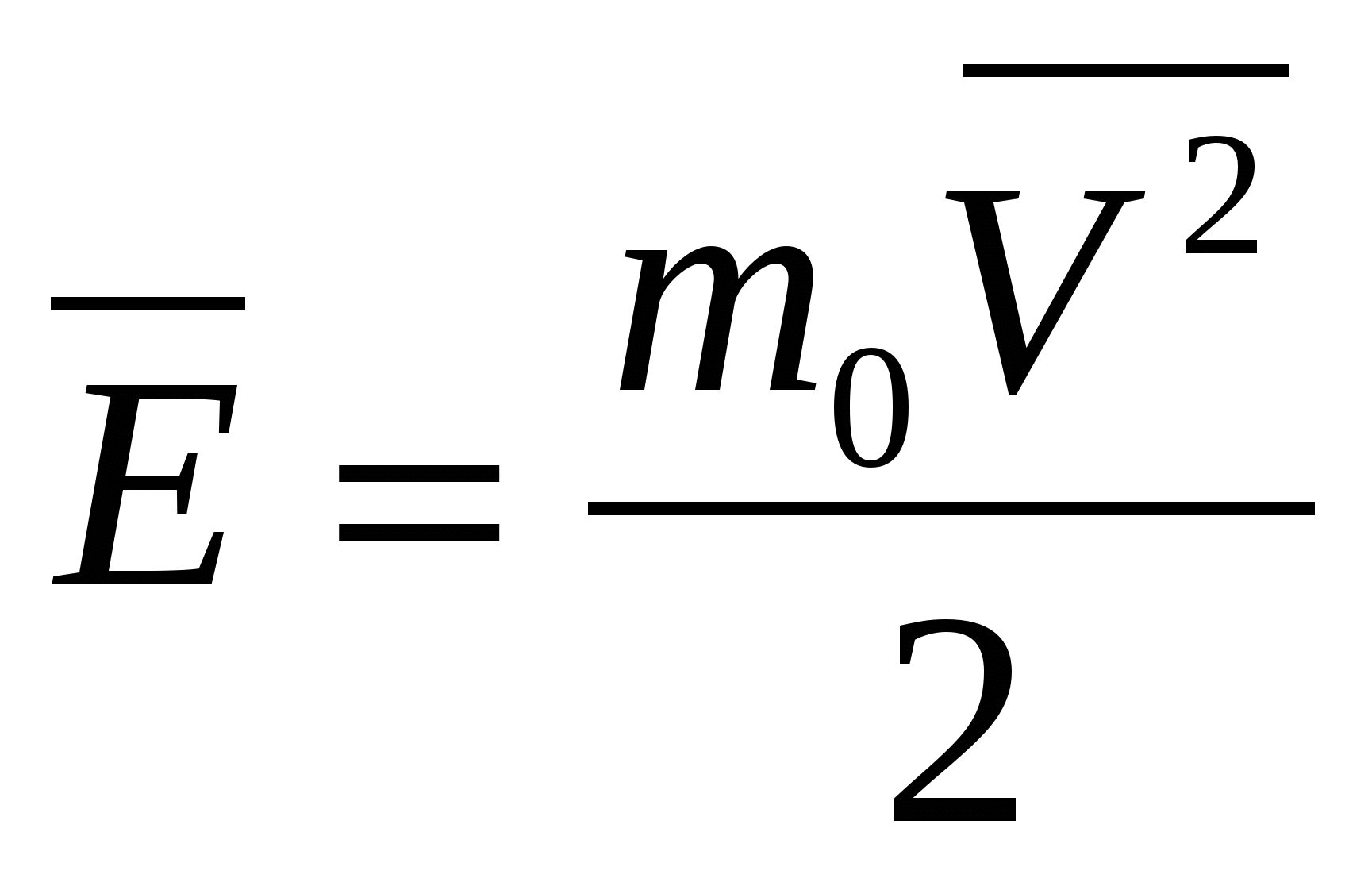
 С учетом основного уравнения МКТ имеем:
С учетом основного уравнения МКТ имеем:
Из этой формулы видно, что средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре.
10ž В этой формуле k=1, 38-23 Дж/К – постоянная Больцмана.
Д 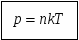 авление газа зависит от концентрации молекул. Эта зависимость выражается формулой:
авление газа зависит от концентрации молекул. Эта зависимость выражается формулой:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|