
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Типы химических реакций.. 2). Типы химических реакций.
Типы химических реакций.
1) Химическая реакция (или химическое явление) – это процесс, в результате которого из одних веществ образуются другие вещества, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам.
Например: 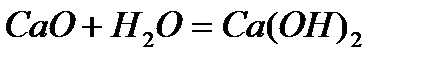 , ! Демонстрационный опыт –
, ! Демонстрационный опыт –
гашение «негашеной» извести
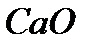 где - оксид кальция (II),
где - оксид кальция (II),
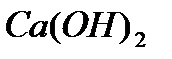
- гидроксид кальция (II)
2). Типы химических реакций.
1. По числу и составу исходных веществ и продуктов реакции
2. По тепловому эффекту
3. По признаку обратимости
4. По признаку изменения степеней окисления
5. По агрегатному состоянию веществ
6. По наличию катализатора.
1. По числу и составу исходных веществ и продуктов реакции:
| Реакции соединения | Реакции разложения | Реакции замещения | Реакции обмена |
| Из нескольких веществ образуется одно новое вещество | Из одного вещества образуется несколько новых веществ | Атомы простого вещества замещают атомы одного из элементов в сложном веществе | Два сложных вещества обмениваются своими составными частями |
| S + O2 = SO2 где SO2 - оксид серы (IV) | 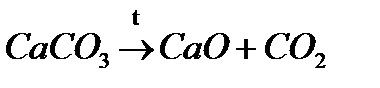
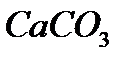 где - карбонат кальция где - карбонат кальция
| Zn + 2HCl = = ZnCl2 + H2↑ где HCl – соляная кислота, ZnCl2 - хлорид цинка | NaOH + HCl = = NaCl + H2O где NaOH – гидроксид натрия, NaCl – хлорид натрия |
! Демонстрационный опыт – взаимодействие цинка с соляной кислотой; взаимодействие гидроксида натрия с соляной кислотой
2. По тепловому эффекту:
а) Экзотермические реакции - протекают с выделением теплоты
С + O2 = СO2 + Q
где СO2 - оксид углерода (IV)
б) Эндотермические реакции -протекают с поглощением теплоты
N2 + O2 = 2NO – Q
где NO - оксид азота (II)
3. По признаку обратимости:
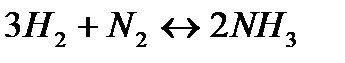 а) Обратимые реакции -протекают одновременно в двух противоположных направлениях
а) Обратимые реакции -протекают одновременно в двух противоположных направлениях
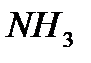
где - аммиак
б) Необратимые реакции - протекают только в одном направлении
Признаки необратимости:
· образование осадка
· образование слабого электролита (Н2О),
· выделение газа,
· выделение большого количества теплоты
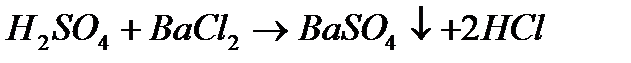 ! Демонстрационный опыт –
! Демонстрационный опыт –
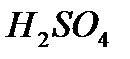 взаимодействие серной
взаимодействие серной
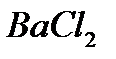 где - серная кислота кислоты с хлоридом бария
где - серная кислота кислоты с хлоридом бария
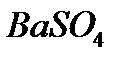 - хлорид бария
- хлорид бария
- сульфат бария (белый осадок)
4. По признаку изменения степени окисления:
Окислительно – восстановительные реакции протекают:
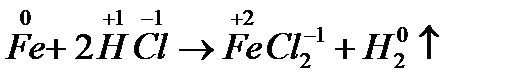 а) с изменением степени окисления
а) с изменением степени окисления
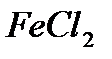
где - хлорид железа (II)
б) без изменения степени окисления элементов
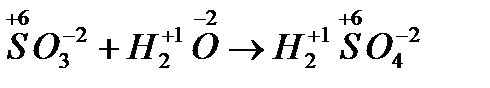
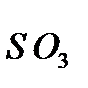
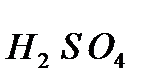 где - оксид серы (VI)
где - оксид серы (VI)
- серная кислота
5. По агрегатному состоянию веществ:
а) Гетерогенные реакции - протекают в неоднородной среде, на поверхности раздела фаз (т-г, т-ж, ж-г, т-т)
 ! Демонстрационный
! Демонстрационный
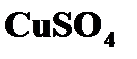 опыт - взаимодействие
опыт - взаимодействие
где - сульфат меди железа с раствором
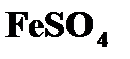 сульфата меди
сульфата меди
- сульфат железа (II)
б) Гомогенные реакции - протекают между веществами в однородной среде, где нет поверхности раздела фаз
H2 (г)+ Cl2 (г) = 2HCl (г)
где HCl – соляная кислота
6. По наличию катализатора:
а) Каталитические реакции протекают с участием катализатора
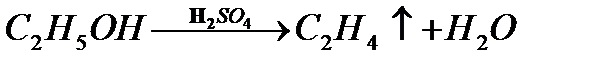
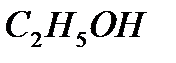
где - этиловый спирт
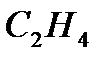
- этилен
б) Некаталитические реакции протекают без участия катализатора
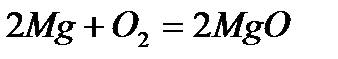
где MgO – оксид магния (II)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|