
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
2. Ионная химическая связь –это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
2. Ионная химическая связь –это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Наиболее устойчивая электронная конфигурация атомов 8 электронов - 2s22p6 и 2 электрона - 1s2.
Me0 -nẽ ↔ Men+ (катионы)
неMe0 +nẽ ↔ неMen- (анионы)
Образуется ионная кристаллическая решётка
Физические свойства: твёрдые, прочные, тугоплавкие. 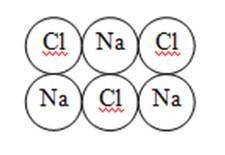
Растворы и расплавы ионных соединений – электролиты.
- Что такое электролиты?
- Определение электролитической диссоциации?
- Три случая образования электролитов?
Ионная связь – крайний случай ковалентной полярой связи, но в оличие от неё связь ненаправленная.
3. Металлическая связь –связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решётке.
Характеристика – ненаправленная, ненасыщенная, небольшое количество валентных электронов, большое количество свободных орбиталей.
Me0 -nẽ ↔ Men+
Физические свойства – твёрдость, тепло- и электропроводность, ковкость, пластичность, металлический блеск.
Металлическая кристаллическая решётка – в узлах ионы или атомы металлов, между которыми свободно перемещаются электроны.
4. Водородная химическая связь – это химическая связь между положительно поляризованными атомами водорода одной молекулы (или её части) и отрицательно поляризованными атомами сильноэлектроотрицательных элементов, имеющих неподелённые электронные пары (F, O, N, реже Cl и S) другой молекулы или другой её части.
Характер связи: частично электростатический, частично донорно-акцепторный.
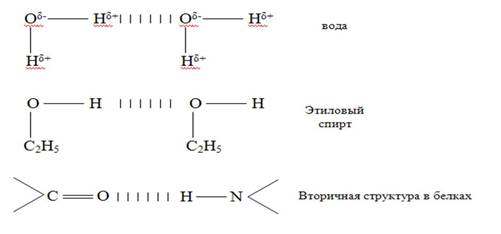
В молекулах ДНК цепи нуклеотидов связаны водородными связями в двойные спирали - принцип комплементарности (Ц-Г, А-Т).
Вещества с водородными связями имеют молекулярные кристаллические решётки.
Единаяприродахимическойсвязи.
Ионная химическая связь – крайний случай ковалентной полярной химической связи. Металлическая связь совмещает в себе ковалентное взаимодействие атомов и электростатическое притяжение между ионами металлов и их электронами.
LiF – 80% ионной связи и 20% ковалентной полярной.
Основания: между кислородом и водородом в гидроксогруппе о ковалентная полярная связь, между металлом и гидроксогруппой – ионная.
Соли: в кислотном остатке – ковалентная полярная, между металлом и кислотным остатком – ионная.
.
Домашнее задание
1. Из предложенного перечня выберите два вещества, в которых присутствуют только ковалентные полярные связи.
1) КNO3
2) C (алмаз)
3) SiO2
4) HNO3
5) Na2S
Решение.
Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ковалентные полярные связи присутствуют в и.
Ответ: 34.
3. Из предложенного перечня выберите два вещества, в которых кислород образует ионные связи.
1) озон
2) оксид кальция
3) углекислый газ
4) оксид меди
5) вода
Запишите в поле ответа номера выбранных соединений.
Решение.
Оксид кальция и оксид меди это ионные соединения, потому что ионная связь образуется между атомами металлов и неметаллов.
Ответ: 24.
4. Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
1) фенол
2) алкан
3) арен
4) спирт
5) алкин
Запишите в поле ответа номера выбранных соединений.
Решение.
Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (, и ), одной молекулы и атомом эле-мента с высокой электроотрицательностью (, , ) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь.
Среди предложенных веществ кислород в составе группы − ОН присутствует только в молекулах спиртов и фенолов, поэтому среди предложенных веществ водородная связь возможна между молекулами спиртов и фенолов. Остальные вещества относятся к углеводородам и не способны к образованию водородных связей
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|