
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей ― процесс обменного взаимодействия ионов соли с во- дой, приводящий к образованию малодиссоциированных продуктов и сопро-
вождающийся изменением рН среды. В результате гидролиза могут образовы- ваться молекулы слабых кислот и оснований, анионы кислых солей или катио- ны основных солей. В большинстве случаев гидролиз является обратимым про- цессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролизу подвергаются только те соли, в состав которых входят ионы слабой кислоты или слабого основания. В связи с этим соли сильных кислот и основа- ний не гидролизуются, например, NaCl, Na2SO4, KNO3 и т. п., реакция среды нейтральная (рН = 7).
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2СО3, в) ZnSO4. Определите реакцию среды рас- творов этих солей.
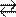 Решение, а) Цианид калия KCN – соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основании КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN–. Катионы К+ не могут связывать ионы ОН– воды, так как КОН – сильный электролит. Анионы же CN– связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
Решение, а) Цианид калия KCN – соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основании КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN–. Катионы К+ не могут связывать ионы ОН– воды, так как КОН – сильный электролит. Анионы же CN– связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
 или в молекулярной форме
или в молекулярной форме
CN– + H2O HCN + OH–
KCN + Н2О HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН–, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2СО3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO2–3, связывая водородные ионы воды, образуют анионы кислой соли НСО–3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CO2–3 + Н2О  НCO–3 +ОН–
НCO–3 +ОН–
или в молекулярной форме
Na2CO3 + H2O 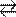 NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН–, поэтому раствор Na2CО3 имеет ще- лочную реакцию (рН > 7).
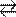 в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(ОН)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гид- роксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гид- ролиза:
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(ОН)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гид- роксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гид- ролиза:
Zn2+ + Н2О ZnOH+ + Н+
или в молекулярной форме:
2ZnSO4 + 2Н2О  (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (pH < 7).
Пример 2. Какие продукты образуются при смешивании растворов А1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнения реакции.
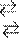 Решение. Соль А1(NО3)3 гидролизуется по катиону, а К2СО3 – по аниону: Al3+ + Н2О АlOН2+ + Н+
Решение. Соль А1(NО3)3 гидролизуется по катиону, а К2СО3 – по аниону: Al3+ + Н2О АlOН2+ + Н+
CO2–3 + H2O HCO3+ + OH–
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН– образуют молекулу слабого элек- тролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гид- ролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2(Н2СО3). Ионно-молекулярное уравнение:
2 А13+ + 3CO2–3 + 3 Н2О = 2 Аl(ОН)3 + 3 СО2
молекулярное уравнение:
2 Al(NO3)3 + 3 К2СО3 + 3 Н2O =2 А1(ОН)3 + 3 СО2 + 6 KNO3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|