
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тиосульфат натрия, гипосульфит, антихлор.
Тиосульфат натрия, гипосульфит, антихлор.
Антихлор- вещество, препятствующее разрушительному действию хлора. Так называются некоторые соли, которые легко окисляют хлор. При отбелевании тканей применяется хлор. И для удаления остатков хлора используют тиосульфат натрия: Nа2S2О3 (Nа2SО3S)
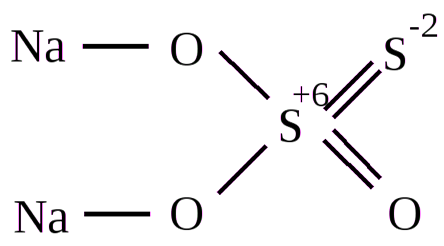
Тиосерная кислота — неорганическое соединение, двухосновная сильная кислота с формулой H2S2O3 или H2SO3S. Бесцветная вязкая жидкость, реагирует с водой. Образует соли — неорганические тиосульфаты. В свободном состоянии не получена, так как неустойчива и даже при комнатной температуре легко разлагается:
H2SO3S→ S + SO2 + Н2О
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Nа2SО3S + Н2SО4→ Nа2SО4 + S + SO2 + Н2О
Na2S2O3 + 2НСl → 2NaCl + SO2↑ + S↓ + H2O
Na2S2O3 + CO2 + H2O → Na2CO3 + H2S2O3 (даже слабой угольной к-той)
H2S2O3 → S↓ + SO2↑ + H2O
Устойчивыми являются ее соли.
Получение:
1. Кипячение избытка серы с сульфитом натрия:
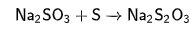
2. Кипячение избытка серы с гидроксидом натрия:
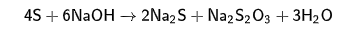
2S +6ОН- -4е-→ S2O32- +3Н2О
S + 2е-→ S2-
2S +6 ОН- + 2S → S2O32- +2S2- +3 Н2О
3. Взаимодействием H2S и SO2 с NaOH
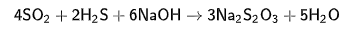
2SО2 +Н2О +4е-→ S2O32- +2ОН-
2Н2S + 10 ОН- -8е-→ S2O32- +7 Н2О
4SО2 +2Н2О+ 2Н2S + 10 ОН-→ 2 S2O32- +4ОН- + S2O32- +7 Н2О
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|