
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гидролиз многозарядных ионов протекает ступенчато
Гидролиз многозарядных ионов протекает ступенчато
Ионное уравнение гидролиза по 1 ой ступени:
CO3 -2+ Н2О < => HCO3- + OH- ( щелочная среда (рН> 7)
(анионы соли взаимодействуют с водой, образуется слабую кислоту и избыточное количество ионов ОH- )
КГ1 = 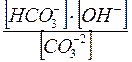 =
= 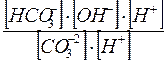 =
= 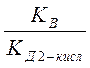
Для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени
Ионное уравнение гидролиза по 2- ой ступени:
НCO3 ‾ + Н2О < => H2CO3 + OH ‾
КГ2= Кс2·[Н2О]= 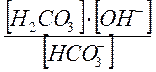 =
= 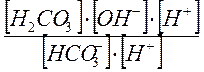 =
= 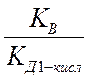
Т. к. КД2< КД1=> КГ1=2·10-4 > КГ2=2·10-8 гидролиз идет преимущественно по первой ступени
Определение рН (соль слаб. к-та + сильн. осн. )
рН=14 – рOH рOН=-lg аОН‾ аОН‾ = γ ОН‾ ∙ СОН‾
в разбавленных растворах γ ОН‾ =1 и а ОН‾ = с ОН‾
рОН=-lg аОН‾ = -lg С ОН‾ = -lg b∙ С0= -lg C0 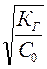 =-lg
=-lg 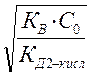
С0 - исходная концентрация анионов соли
3. Соли, образованные слабыми кислотами и слабыми основаниями (NH4CN, Pb(CH3COO)2, Al2S3 и т. д. ).
NH4СN→ NH4 ++ CN ‾
Ионное уравнение гидролиза:
NH4 + + Н2О < => NH4OH + H+ и СN ‾ + Н2О < => HСN + OH‾
или NН4+ + СN- + Н2О Û NН4ОН + НСN
(анионы и катионы соли одновременно взаимодействуют с водой, рН среды определяется соотношением КД-осн и КД-кисл )
КГ = 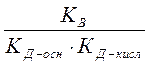 КД(NH4OH)=1, 79× 10-5 > КД(НСN) =7, 9× 10-10 Þ pH > 7
КД(NH4OH)=1, 79× 10-5 > КД(НСN) =7, 9× 10-10 Þ pH > 7
b= 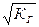 =
= 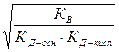 (степень гидролиза не зависит от С0)
(степень гидролиза не зависит от С0)
CН+= 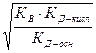 (CН+ не зависит от С0)
(CН+ не зависит от С0)
Определение рН (соль слаб. к-та + слаб. осн. )
рН =-lg аН+ аН+= γ Н+∙ CН+ в разбавленных растворах γ Н+=1 и аН+= CН+
рН =-lg аН + = -lg CН+ = -lg 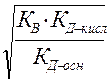
4. Соли, образованные сильными кислотами и сильными основаниями (NaCl, KBr, CsI, RbNO3 и т. д. ). Гидролиз не идет, рН около 7
Гидролиз – обратимый равновесный процесс, характеризуется константой гидролиза Сместить гидролитическое равновесие в сторону усиления гидролиза можно путем а) разбавления б)повышения температуры (эндотермическая реакция)
г) удаления продуктов гидролиза из сферы реакции
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|