
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
2.2. p-элементы.
ОБЩАЯ ХАРАКТЕРИСТИКА. p-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь. В p-блок входят последние шесть групп главной подгруппы, исключая гелий (который находится в s-блоке). Данный блок содержит все неметаллы (исключая водород и гелий) и полуметаллы, а также некоторые металлы. p-блок содержит в себе элементы, которые имеют различные свойства, как физические, так и механические. p-неметаллы — это, как правило, высокореакционные вещества, имеющие сильную электроотрицательность, p-металлы — умеренно активные металлы, причём их активность повышается к низу таблицы химических элементов. [10]
БОР. Основной минерал - бура - Na2B4O7. Бор неметалл, типичные степени окисления +3 и -3, получают восстановлением его оксида магнием:
B2O3 + 3Mg = 2B + 3MgO
Растворяется в кислотах-окислителях, но солей подобно Al, Ga, In, Tl не образует, а превращается в борную кислоту:
2В + 3H2SO4конц. = 2H3BO3 + 3SO2; B + 3HNO3конц. = H3BO3 + 3NO2
При нагревании бор реагирует с кислородом, галогенами, серой, азотом, образуя соответственно B2O3, BCl3, B2S3, BN, а с водородом - бороводороды В2Н6 - диборан, В4Н10 - тетраборан.
АЛЮМИНИЙ. Распространенность в земной коре - 9%. Единственный природный изотоп - 27Al13. Почти весь алюминий сосредоточен в алюмосиликатах. Алюминий - серебристо-белый металл, легко проводит электрический ток, образует сплавы с другими металлами. Характерная степень окисления +3. Довольно активный металл и вступает во множество реакций. Однако, на воздухе покрыт прочной оксидной пленкой (Al2O3), которая не удаляется при механической обработке и нагревании, что придает стойкость изделиям из алюминия к внешним воздействиям.
Химические свойства алюминия:
1. Взаимодействие с кислородом. Защитная пленка препятствует окислению на воздухе. Но при тонком измельчении и устранении оксидной пленки (погружением в горячую щелочь) алюминий сгорает с ослепительным блеском (∆ H = -1676 кДж/моль), с образованием оксида алюминия, а в присутствии воды - гидроксида алюминия:
4Al + 3O2 = 2Al2O3; 4Al + 3O2 + 6H2O = 4Al(OH)3
2. Элемент активно реагирует с неметаллами, сгорая в атмосфере фтора и хлора, соединяясь с бромом, йодом, серой, азотом, фосфором, углеродом при нагревании. С водородом прямо не взаимодействует и гидриды типа (AlH3)n получают косвенным путем.
3. При нагревании алюминий (лишенный оксидной пленки) образует с водой оксид алюминия, а без нагревания - гидроксид алюминия:
2Al + 3H2O = Al2O3 + 3H2 (реакция идёт при нагревании);
2Al + 6H2O = 2Al(OH)3 + 3H2
5. Алюминий вытесняет из растворов солей менее активные металлы:
Al + 3CuCl2 = 3Cu + 2AlCl3
6. Алюминий растворяется в кислотах-неокислителях с выделением водорода (в фосфорной и уксусной кислоте растворяется при нагревании).
2Al + 3H2SO4разб. = Al2(SO4)3 + 3H2
7. Алюминий пассивируется концентрированными H2SO4 и HNO3, поэтому эти кислоты можно хранить в алюминиевой таре, но реагирует с разбавленной азотной кислотой.
8. Алюминий растворяется в щелочах с выделением водорода.
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2;
9. Алюминий растворяется в растворах окислителей и сплавляется с окислителями:
10Al + 6KMnO4 + 24H2SO4 = 5Al2(SO4)3 + 3K2SO4 + 6MnSO4 + 24H2O
УГЛЕРОД. Природный углерод имеет 2 стабильных изотопа: 12С6 - 98, 9%, 13С6 - 1, 1%. Известны и радиоактивные изотопы. В литосфере углерода - 0, 35%. В свободном состоянии углерод образует месторождения графита, алмазов. Много углерода имеется в составе углей, нефти, природного газа, минералов - известняка (CaCO3), магнезита (MgCO3), малахита - (CuOH)2CO3. В воздухе углерод присутствует в виде СО2.
Химические свойства:
Химические свойства углерода обычно рассматриваются на примере графита или углей, поскольку алмаз химически неактивен. Углерод малоактивное вещество и в реакции вступает при нагревании или поджигании, что связано с затратами энергии для разрушения кристаллической решетки.
1. Взаимодействие с водородом происходит при высокой температуре и
наличии катализатора (Ni):
C + 2H2 = CH4
2. Взаимодействие с кислородом. При сгорании углей образуется
диоксид углерода (СО2). Реакция экзотермична (∆ H = -395 кДж/моль), хотя и требует инициации (поджигания). Если не хватает кислорода то часть несгоревшего угля взаимодействует с диоксидом углерода, образуя монооксид углерода. Для предотвращения образования токсического угарного газа, сжигание угля нужно вести в избытке кислорода:
C + O2 = CO2; С + СО2 = 2СО (угарный газ)
3. Углерод непосредственно взаимодействует только с фтором. Соединения с хлором, бромом, йодом получают косвенным путем:
С + 2F2 = CF4
4. Углерод при нагревании соединяется с серой и азотом:
C + 2S = CS2 (сероуглерод) (реакция идёт при нагревании)
Сероуглерод является хорошим растворителем жиров, смол, лаков.
5. При высокой температуре углерод образует с металлами карбиды:
2C + Ca = CaC2
В карбидах углерод может иметь степени окисления, не отвечающие обычным представлениям.
6. При нагревании углерод окисляется азотной и конц. серной кислотами, хотя на холоду устойчив к действию этих и других кислот.
Применение углерода:
1. Сажу используют как наполнитель при производстве резины и как типографскую краску.
2. Соединения углерода - каменный уголь, природный газ, нефть - топливо.
3. Восстановитель в металлургии.
4. Адсорбент.
АЗОТ. Изотопы: 14N7 - 99, 6%, 15N7 - 0, 4%. Азот самый распространенный газ атмосферы (78 об. %). В земной коре азота мало и большая часть содержится в виде органических соединений, из минералов известны селитры.
Физические свойства азота:
Газ без цвета и запаха, плохо растворим в воде (до 1. 5%). Молекула азота (N2) необычайно прочна. Для разрыва связей требуются большие затраты энергии - ∆ H = -946 кДж/моль. Поэтому молекулярный азот малоактивное вещество, подобное инертным газам. Он не взаимодействует с водой, галогенами, серой, углеродом, фосфором, щелочами, азотной, соляной и серной кислотой. Азот применяется для получения аммиака и создания инертной среды.
Химические свойства азота:
1. Взаимодействие с водородом;
2. Образование нитридов;
3. Взаимодействие с кислородом происходит при очень высокой
температуре;
4. При нагревании азота с карбидом кальция или коксом образуется цианамид кальция или дициан:
СаС2 + N2 = C + CaCN2 (цианамид Ca); 2С + N2 = (CN)2 (дициан)
Азотные удобрения:
1. Минеральные: твердые - селитры (нитраты натрия, калия, аммония), мочевина (СО(NH2)2), жидкие - аммиачная вода, жидкий аммиак.
2. Органические: навоз, компост, птичий помет.
3. Зеленые: растения, содержащие клубеньковые бактерии (бобовые) накапливают в почве азот.
ФОСФОР: Единственный стабильный изотоп - 15P. Существуют искусственные радиoактивные изотопы. На внешнем уровне атом фосфора имеет 5 электронов - 3s23p3, из которых три электрона не спарены. Типичные степени окисления +3, +5 и -3, реже +1. Важнейшие минералы - фосфорит - Ca3(PO4)2, апатит - 3Ca3(PO4)2.
Аллотропические модификации. Белый фосфор - белое кристаллическое вещество, получают охлаждением паров фосфора. Светится в темноте, воспламеняется на воздухе, ядовит. Имеет молекулярную кристаллическую решетку, напоминающую таковую у алмаза, в узлах решетки расположены тетраэдрические молекулы Р4. Красный фосфор - темно-малиновый порошок, нерастворим в воде, не светится в темноте, не самовоспламеняется. Имеет полимерное строение - бесконечная цепь молекул Р4. Получают нагреванием белого фосфора при 400°C. Черный фосфор напоминает графит, имеет слоистую кристаллическую решетку, полупроводник. Получают нагреванием красного фосфора при 200°С под давлением 1200 атм.
Химические свойства фосфора:
1. Взаимодействие с водородом происходит при высокой температуре и наличии катализаторов, но водородные соединения фосфора чаще получают косвенным путем (растворением фосфора в щелочах, гидролизом фосфидов).
2. Взаимодействие с кислородом. При недостатке кислорода образуется оксид фосфора (III), а при его избытке - оксид фосфора (V). Белый фосфор загорается без поджигания и продолжает гореть под водой. Фосфор используют в поджигательных смесях - напалм и т. д. ).
3. Взаимодействие с галогенами. С фтором и хлором реакция идет непосредственно, а с бромом и йодом - при нагревании.
4. Фосфор при нагревании соединяется с серой, но не взаимодействует с азотом и углеродом:
2P + 3S = P2S3; 2P + 5S = P2S5
5. Взаимодействие с металлами происходит при нагревании:
3Сa + 2P = Ca3P2
6. Фосфор легко окисляется азотной кислотой и другими окислителями, но не взаимодействует с соляной кислотой, разбавленной серной кислотой:
3P + 5HNO3разб. + 2H2O = 3H3PO4 + 5NO
Применение фосфора:
1. Производство спичек (красный фосфор)
2. Производство поджигательных смесей (белый фосфор).
3. Производство фосфорорганических веществ.
КИСЛОРОД. Самый распространенный на Земле элемент - 47, 2% от массы земной коры, 21% объема атмосферы. В земной коре кислород находится преимущественно в виде воды, карбонатов и силикатов горных пород. Кислород широко распространен в живых организмах.
Физические и химические свойства молекулярного кислорода:
Молекулярный кислород - газ с низкой температурой кипения (-183°C) и плавления (-219°C). В воде растворяется плохо - до 3 объемных %.
Кислород - один из самых активных неметаллов и образует соединения со всеми элементами кроме гелия, неона и аргона. Он не взаимодействует с золотом, платиной и галогенами, хотя кислородные соединения галогенов можно получить косвенным путем. Кислород не
реагирует с сильными кислотами, щелочами, водой. Во всех своих реакциях кислород выступает в роли окислителя (кроме взаимодействия со фтором).
1. Взаимодействие с водородом. Смесь кислорода и водорода в темноте сохраняется неограниченно долго, но при нагревании, электрическом разряде взрывается:
2H2 + O2 = 2H2O
2. Взаимодействие с другими неметаллами. Большинство неметаллов горят в атмосфере кислорода, однако реакция с азотом требует нагревания до 3000°С. Инертные газы и галогены (исключая фтор) непосредственно с кислородом не взаимодействуют и их кислородные соединения получают косвенным путем.
3. Взаимодействие с металлами. Все металлы кроме золота и платины дают оксиды или пероксиды. Активные металлы сгорают в атмосфере
кислорода:
2Na + O2 = Na2O2; 2Mg + O2 = 2MgO; 3Fe + 2O2 = Fe3O4
Применение кислорода:
1. Интенсификация металлургических и других химических процессов:
а) продувание доменных печей при выплавке чугуна и конверторов при выплавке стали;
б) окисление сульфидов цветных металлов (CuS, ZnS) при получении из руд;
в) окисление серы и пирита в производстве серной кислоты.
г) окисление аммиака в производстве азотной кислоты.
2. Кислородно-ацетиленовое и кислородно-водородное пламя.
3. Медицина.
СЕРА. На последнем электронном уровне 3s23p4. Имеет 4 стабильных изотопа. В природе сера встречается 1) в самородном виде: Сицилия, Западная Украина; 2) в виде минералов: FeS2 - железный колчедан (пирит), ZnS - цинковая обманка, PbS свинцовый блеск, CuS2 - медный блеск, HgS - киноварь; 3) в виде сульфатов минералы - CaSO4·2H2O - гипс, Na2SO4·10H2O - мирабилит, MgSO4·7H2O - английская соль и в растворенном виде в воде солей и океанов (Na2SO4, CaSO4, MgSO4, H2S); 4) в составе живых организмов – белки.
Физические свойства серы:
Хрупкое кристаллическое вещество желтого цвета, нерастворимо в воде, но растворяется в органических растворителях.
Есть 3 аллотропных модификации серы - ромбическая сера - кристаллы имеют вид октаэдров, плавятся при 112, 8 градусов. При медленном охлаждении получается моноклинная сера. Обе модификации имеют кольцевую 8-атомные молекулы (S8), различающиеся только пространственным расположением атомов серы. При выливании расплавленной серы в холодную воду, получается пластическая сера, молекулы которой представлены незамкнутой цепью. Она тянется как резина и со временем превращается в ромбическую серу.
Химические свойства серы:
Сера достаточно активный неметалл, проявляет в реакциях с активными неметаллами и окислителями свойства восстановителя, а в реакциях с водородом и металлами - свойства окислителя. Типичные степени окисления -2, +4, +6 (реже +1 и +2).
Реакции с неметаллами. Азот и иод с серой не взаимодействуют. Другие неметаллы соединяются с серой чаще всего при нагревании.
Реакции с металлами. Со многими металлами сера взаимодействует при нагревании, активные металлы соединяются с серой непосредственно:
2Na + S = Na2S; 2Al + 3S = Al2S3
Взаимодействие с окислителями (восстановительные свойства серы). При сплавлении с окислителями или растворении в растворах окислителей окисляется до соединений серы +6 или +4:
K2Cr2O7 + S = K2SO4 + Cr2O3; 2KMnO4 + S = K2SO4 + 2MnO2
2KClO3 + 3S = 3SO2 + 2KCl; KClO3 + S + H2O = K2SO4 + HCl
Применение серы:
1. Получение серной кислоты, сероуглерода.
2. Вулканизация каучука.
3. Изготовление спичек, черного пороха.
4. Борьба с возбудителями грибковых заболеваний растений, окуривание помещений сжиганием серы - образующийся диоксид серы убивает насекомых.
5. Медицина - мази.
ГАЛОГЕНЫ. Атомы галогенов имеют на последнем электронном уровне по 7 электронов - s2p5. Для завершения оболочки им не хватает одного электрона. Особенностью атома фтора является отсутствие d-подуровня. Типичная степень окисления -1. Положительных степеней окисления фтор не имеет. Валентные возможности хлора, брома, йода выше, чем у фтора, поскольку у них имеется незаполненный d-подуровень и при возбуждении электроны последовательно переходят на d-подуровень. Поэтому хлор, бром, иод могут образовывать одну, три, пять и семь связей. Типичными степенями окисления хлора, брома, йода, является -1, +1, +3, +5, +7.
1. Наиболее высока электроотрицательность у фтора 4, 0, затем она падает в ряду Cl, Br, I (2. 83, 2. 7, 2. 2).
2. Все галогены активные окислители. Их окислительная активность уменьшается в ряду F > Cl > Br > I. Вследствие различий в электроотрицательности фтор вытесняет хлор, бром, иод из солей, хлор вытесняет бром и йод, а бром вытесняет йод.
3. В пределах группы меняются и физико-химические свойства галогенов. Фтор и хлор газы, бром - жидкость, иод - твердое вещество.
Распространение в природе:
В свободном виде галогены встречаются только в вулканических
газах. Минералы фтора: CaF2 - флюорит, 3Ca3(PO4)2· CaF2 - апатит. Минералы хлора: NaCl - каменная соль (существует в виде минерала, много хлорида натрия растворено в воде). KCl·NaCl - сильвинит; KCl·MgCl2·6H2O - карналлит; KCl·MgSO4·3H2O - каинит.
Минералы брома и йода: NaBr, NaI, KBr, KI - спутники солей хлора.
Физические и химические свойства галогенов:
Молекулы галогенов двухатомны: F2, Cl2, Br2, I2. Молекулы галогенов достаточно прочны и распадаются на атомы при нагревании или освещении, облучении гамма-лучами. Многие реакции хлора и брома начинаются при освещении и протекают по цепному механизму и со взрывом. Фтор и хлор - газы желто-зеленого цвета, бром - тяжелая жидкость бурого цвета. Иод - кристаллическое вещество с металлическим блеском.
Преобладающим свойством галогенов являются окислительные свойства. Фтор наиболее сильный окислитель из всех известных веществ, затем хлор, бром, иод. Начиная с хлора, галогены способны сами окисляться и в кислородных соединениях проявляют положительные степени окисления.
Химические свойства галогенов представлены в таблице 4. [1, 7, 12]
Таблица 4. Химические свойства галогенов.
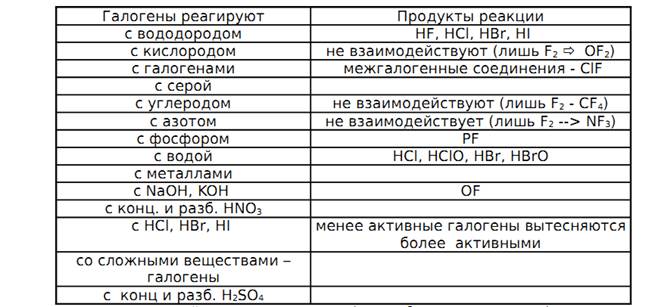
Биологическая роль некоторых p-элементов:
БОР. Бор относится к примесным микроэлементам, его массовая доля 8 организме человека составляет 10-5 %. Бор концентрируется главным' образом в легких (0, 34 мг), щитовидной железе (0, 30 мг), селезенке (0, 26 мг), печени, мозге (0, 22 мг), почках, сердечной мышце (0, 21 мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в идее труднорастворимых солей борной кислоты с катионами металлов. Избыток бора вреден для организма. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, умешает активность адреналина.
АЛЮМИНИЙ. По содержанию в организме человека (10-5 %) относится к примесным элементам. Алюминий концентрируется главным образом в сыворотке крови, лёгких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека. Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветворении.
УГЛЕРОД. По содержанию в организме человека (21, 15 %) относится к макроэлементам. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов. Пыль, состоящая из частиц угля (С), диоксида кремния, алюминия при систематическом воздействии на лёгкие вызывает заболевание – пневмокониозы. При действии угольной пыли – это антракоз – профессиональное заболевание шахтёров.
АЗОТ. По содержанию в организме человека (3, 1 %) относится к макроэлементам. Азот – составная часть аминокислот, белков, витаминов, гормонов. Почти все животные должны получать хотя бы часть необходимого им азота в виде аминокислот, т. к. их организмы не способны синтезировать все аминокислоты из более простых предшественников. Присутствие избытка азота в крови может быть причиной развития кессонной болезни. При быстром подъёме водолазов происходит резкое падение давления – соответственно падает растворимость азота в крови (закон Генри) и пузырьки элементного азота, выходящие из крови, закупоривают мелкие сосуды, что может привести к параличу и смерти.
ФОСФОР. По содержанию в организме человека (0, 95 %) относится к макроэлементам. Фосфор является основой скелета животных и человека, зубов.
КИСЛОРОД. По содержанию в организме человека (62 %) относится к макроэлементам. Он незаменим и принадлежит к числу важнейших элементов, составляющих основу живых систем, т. е. является органогеном. Аллотропную модификацию – озон О3 как очень сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды. Небольшая примесь озона в воздухе создаёт ощущение приятной свежести и благотворно действует на состояние человека, особенно легочных больных. При использовании О2 и О3 следует учитывать их токсичность, обусловленную интенсификацией процессов окисления в организме.
СЕРА. По содержанию в организме человека (0, 16 %) относится к макроэлементам. Как и кислород, она жизненно необходима. Много серы содержится в каротине волос, костях, нервной ткани.
ФТОР. По содержанию в организме человека (10-5 %) относится к примесным элементам. Интерес к биологическому действию фтора связан, прежде всего, с проблемой зубных болезней, т. к. фтор предохраняет зубы от кариеса. Обогащение питьевой воды фтором, т. е. фторирования воды с целью доведения содержания в ней фтора до нормы (1, 2 мг/л), приводит к значительному снижению заболеваемости населения кариесом зубов. Фторирование питьевой воды осуществляется добавлением к ней определённого количества фторида натрия. Вреден не только недостаток, но и избыток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (ПДК) (1, 2 мг/л) зубная эмаль становится хрупкой, легко разрушается и появляются другие симптомы хронического отравления фтором – повышение хрупкости костей, костные деформации и общее истощение организма. Возникающее в этом случае заболевание называется флуорозом (фторозом).
ХЛОР. По содержанию в организме человека (0, 15 %) относится к макроэлементам. Элементный хлор – высокотоксичный газ, применявшийся в первую мировую войну в качестве отравляющего вещества. ПДК газообразного хлора в воздухе 0, 001 мг/л. [1, 8]
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|