
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: «Количественный анализ».
федеральное государственное бюджетное
профессиональное образовательное учреждение
«ПЕНЗЕНСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
БАЗИСНЫЙ ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ
Тема: «Количественный анализ».
ОП. 10 Аналитическая химия
специальность 33. 02. 01 Фармация
курс 1, 2а
Рассмотрено на заседании ЦМК профессиональных модулей по специальности Фармация
Протокол№______от ______________2018 г.
Руководитель ЦМК __________/Баева Н. В. /
Дата регистрации_____________2018г.
Методист _________________/ГоринаЛ. Ю. /
Составила преподаватель: Антипина Л. В
г. Пенза
2020 г.
ЛЕКЦИЯ №17
ТЕМА: «Количественный анализ».
План:
1. Основные сведения о титриметрическом анализе.
2. Требования к реакциям, лежащим в основе методов анализа.
3. Классификация методов.
4. Титр и титрованные растворы. Растворы с приготовленным титром и установленным титром. Исходные вещества, требования к ним.
5. Понятие о поправочном коэффициенте. Стандарт-титры.
6. Точка эквивалентности. Индикаторы.
7. Способы титрования.
8. Измерительная посуда.
1. Заключительный этап химического анализа – количественное определение. Оно выполняется после того, как анализируемое вещество идентифицировано и установлена его доброкачественность. Количественный анализ осуществляется различными методами по определенным методикам.
Метод – это краткое определение принципов, положенных в основу анализа. Для количественного определения применяют 3 группы методов:
· ИМА (инструментальные методы анализа)
· Химические методы
· Биологические методы
Титриметрический анализ объединяет группу методов количественного химического анализа, основанных на измерении объема раствора титранта точной концентрации, необходимого для взаимодействия с определенным количеством анализируемого вещества.
Титриметрические методы – наиболее распространенные методы в фармацевтическом анализе, они отличаются простотой выполнения, достаточно высокой точностью.
Сущность титриметрического анализа заключается в постепенном прибавлении титрованного раствора до тех пор, пока его количество не будет эквивалентно количеству определяемого вещества. Это прием называется титрованием.
2. Требования к реакциям, лежащим в основе методов анализа:
Ø Реакция должна проходить строго по определенному уравнению без побочных реакций, т. е. быть стехиометричной.
Ø Окончание реакции должно точно фиксироваться, чтобы количество титранта было эквивалентно определяемому веществу. На эквивалентности реагирующих веществ основаны вычисления результатов анализа.
Ø Реакция должна протекать с достаточной скоростью и быть практически необратимой. Точно фиксировать точку эквивалентности при медленно идущих реакциях почти невозможно.
Ø Посторонние вещества, присутствующие в растворе, не должны взаимодействовать с титрантом.
3. В титриметрическом анализе используются самые различные типы реакций.
В зависимости от типа реакций, лежащих в основе каждого метода, их разделяю на:
1) Кислотно-основные методы:
- алкалиметрия;
- ацидиметрия.
2) Редокс-методы – в основе лежат ОВР (окислительно-восстановительные реакции):
- перманганатометрия;
- иодометрия;
- броматометрия;
- нитритометрия и др.
3) Методы осаждения – в основе лежат реакции осаждения:
- аргентометрия;
- тиоцианометрия;
- меркуриметрия.
4) Комплексонометрия (трилонометрия) – в основе лежат реакции комплексообразования.
4. Титрант (рабочий раствор)– это раствор, с помощью которого проводится титриметрическое определение, т. е. это раствор которым титруют. Это растворы с точно известной концентрацией.
Существует два метода приготовления титрованных растворов:
1) По точной навеске.
Навеску вещества, рассчитанную для приготовления раствора заданной концентрации, взвешивают на ручных весочках, уточняют на аналитических весах. Затем переносят в мерную колбу определенной вместимости и растворяют в небольшом количестве воды очищенной. Затем объем раствора доводят водой очищенной до метки, закрывают пробкой и перемешивают. Это раствор с приготовленным титром.
Вещества, из которых можно приготовить раствор по точной навеске, должны отвечать следующим требованиям:
· должны быть химически чистыми;
· формула химического соединения должна точно соответствовать химическому составу;
· вещество должно быть устойчиво при хранении, как в кристаллическом виде, так и в растворе;
· молярная масса эквивалента должна быть достаточно большой;
· вещество должно быть доступно и недорого.
Например: H2C2O4*2H2O, Na2CO3, Na2B4O7*10H2O, KBrO3, K2Cr2O7, MgSO4*7H2O, ZnSO4*7H2O.
2) Если вещества не удовлетворяют этим требованиям, то готовят раствор приблизительной концентрации. Для этого приблизительную навеску вещества, рассчитанную для приготовления раствора определенной концентрации переносят в сосуд, предварительно откалиброванный на необходимый объем и растворяют в небольшом количестве воды очищенной. После объем раствора доводят водой очищенной до метки и перемешивают. Проводят его стандартизацию по раствору с приготовленным титром. Такие растворы называют растворами с установленным титром.
Натример: H2SO4, HCl, NaOH, I2, Na2S2O3*5H2O, KMnO4, NaNO2, AgNO3, NH4SCN, Трилон Б.
Титр растворов с течением времени меняется и его надо периодически проверять.
Титр (Т г/мл или г/см3) - это количество вещества в граммах, которое содержится в 1 мл раствора.
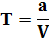
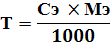
Например, Т HCl = 0, 03645 г/мл. Это означает, что в 1 мл раствора содержится такое количество вещества.
5. Поправочный коэффициент (Кп, величина безразмерная)– это число, показывающее во сколько раз крепче или слабее приготовленный раствор по сравнению со стандартным.
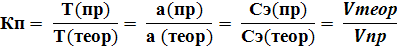
Рекомендуемая величина Кп для проведения анализа по ГФ XIV: 0, 98-1, 02. При отклонении величины Кп от указанных пределов титрованный раствор необходимо разбавить или укрепить.
1) VH2O = (Кп – 1) * Vт-та
2) Mв-ва = (1-Кп) * а в-ва
Если раствор приготовлен из фиксанала, то К=1
Фиксаналы (стандарт-титры)ими удобно пользоваться для приготовления титрованных растворов. Они представляют собой запаянные ампулы с точными навесками веществ. На каждой ампуле указано название вещества, количество, которое находится в ампуле. Приготовление титрованных растворов из фиксаналов очень быстрое и удобное.
6. Момент титрования, при котором количество прибавляемого вещества эквивалентно количеству определяемого вещества называется точкой эквивалентности. Чем точнее фиксируется точка эквивалентности, тем точнее результат анализа.
На практике в процессе титрования фиксируют точку конца титрования– это момент, когда индикатор резко меняет свою окраску. Этот момент не всегда совпадает с точкой эквивалентности, а находится около нее. При титровании всегда подбирается такой индикатор, при котором разность между точкой эквивалентности и точкой конца титрования наименьшая.
Индикаторы– это вещества, которые применяются в титриметрическом анализе для установления точки эквивалентности.
Индикаторы бывают внутренние и внешние. Внутренние индикаторы вводят в анализируемый раствор, а внешние оставляют вне сферы реакции.
Для усиления контрастности иногда используют смешанные индикаторы, которые имеют более узкий интервал перехода окраски. При этом один индикатор выполняет роль фона (метилоранж + метиленовый синий).
Индикаторы делятся на:
Ø Кислотно-основные (фенолфталеин, метилоранж)
Ø Редокс-индикаторы (крахмал)
Ø Индикаторы методов осаждения (калия хромат, эозинат натрия, бромфеноловый синий, железо-аммонийные квасцы)
Ø Индикаторы метода комплексонометрии (кислотный хром темно-синий, мурексид).
7. В титриметрическом анализе различают следующие способы титрования:
1) Прямое титрование – это непосредственное титрование анализируемого вещества титрованным раствором. В колбу для титрования к анализируемому веществу прибавляют титрант до точки эквивалентности.
Расчет ведут по формулам прямого титрования:
| Для субстанции | Для лекарственной формы |
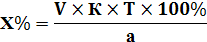
|
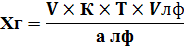
|
| С разведением | |
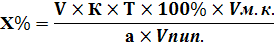
| 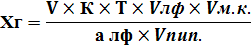
|
2) Обратное титрование – это взаимодействие анализируемого вещества с избытком первого титранта, непрореагировавшую часть которого титруют вторым титрантом, т. е. используют два рабочих раствора. (В колбу для титрования к анализируемому веществу прибавляют точно отмеренный объем первого рабочего раствора V1 в избытке, часть его реагирует с определяемым веществом, а оставшуюся часть оттитровывают вторым титрантом).
Расчет ведут по формулам обратного титрования:
| Для субстанции | Для лекарственной формы |
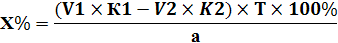
|
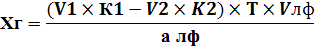
|
| С разведением | |

| 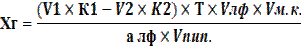
|
3) Косвенное (заместительное) титрование – это взаимодействие анализируемого вещества со вспомогательным реагентом, в результате которого выделяется эквивалентное количество продукта реакции, который титруют рабочим раствором. Применяют в тех случаях, когда применение прямого или обратного титрования невозможно.
Расчет ведут по формулам прямого титрования.
Для повышения точности титрования иногда ставят контрольный опыт («холостое» титрование). Точно повторяют методику титрования, но без определяемого вещества. При расчете из объема титранта, пошедшего на титрование, вычитают объем контрольного опыта.
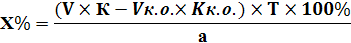
8. Измерительная посуда, применяемая в количественном химическом анализе, включает точную мерную посуду: бюретки, пипетки, мерные колбы, а также мерную посуду более низкого класса – мерные цилиндры. Пипетки и бюретки градуируются на выливание, мерные колбы калибруют на вливание.
Мерные колбы применяют для приготовления растворов строго определенной концентрации, либо для разбавления точно измеренного объема (аликвотной части) раствора более высокой концентрации.
При приготовлении растворов соответствующую навеску вещества вносят в колбу через сухую воронку, затем остатки вещества смывают с воронки водой очищенной, наполняя колбу до середины объема; раствор взбалтывают до полного растворения навески. При выделении тепла раствор охлаждают до комнатной температуры. Затем уровень жидкости в колбе доводят водой до уровня приблизительно на 1 см ниже метки, затем при помощи пипетки по каплям добавляют до метки. Глаз должен находиться в одной горизонтальной плоскости с круговой меткой на шейке мерной колбы. Закрывают пробкой и тщательно перемешивают, переворачивая колбу вниз пробкой не менее 10 раз.
Бюретки представляют собой длинные стеклянные трубки с краном или другим запорным устройством. Это может быть надетая на конец бюретки резиновая трубка со стеклянным оттянутым наконечником, которая либо пережимается металлическим зажимом, либо в нее вставлен стеклянный шарик, служащий запором. Бюретки изготавливают различной вместимостью: 50, 25, 10, 5, 1 мл. Бюретки вместимостью 5 мл и менее называют микробюретками. Предназначены бюретки для измерения объема вылитой из них жидкости, т. е. для титрования анализируемых веществ титрованными растворами. Бюретки укрепляют в штативе на расстоянии 10-15 см от верхнего края бюретки.
Бюретки со стеклянным краном применяют для растворов веществ, действующих на резину (растворов перманганата калия, йода, нитрата серебра). Сухой стеклянный кран смазывают вазелином. Для растворов гидроксидов щелочных металлов нельзя использовать бюретки со стеклянным краном, так как щелочь разъедает стекло и кран перестает открываться.
Перед началом титрования бюретку тщательно моют водой так, чтобы вода стекла по стенкам, а не накапливалась отдельными каплями. Непосредственно перед титрованием бюретку споласкивают 2-3 раза рабочим раствором для удаления воды. Перед каждым новым титрованием ее заполняют до верхнего (нулевого) деления, предварительно заполняя рабочим раствором носик бюретки.
При титровании кран или зажим регулируют левой рукой, а колбу для титрования вращают правой рукой. Носик бюретки должен быть введен в колбу для титрования на 1, 5-2 см.
Проводят не менее трех параллельных титрований, причем отклонения в результатах титрования допустимы в пределах ± 0, 05мл.
Пипетки – стеклянные длинные трубки с цилиндрическим или шаровым расширением посередине. Предназначены для точного отбора определенного объема жидкости, перенесения его из одного сосуда в другой. Пипетки выпускают двух типов: пипетки Мора - рассчитанные на выливание, указанного на них объема жидкости и градуированные, которыми производят процесс титрования, т. е. выливают по частям.
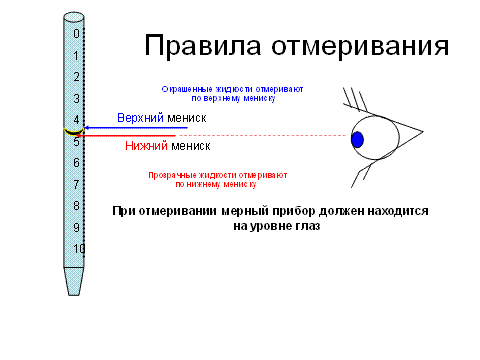
При работе с пипеткой необходимо придерживаться следующего: перед применением пипетку промывают водой очищенной, высушивают или ополаскивают два раза анализируемым раствором. Для взятия жидкости пипеткой ее берут за верхнюю часть большим, средним и указательными пальцами правой руки, погружают глубоко в раствор и засасывают грушей на 2-3 см выше кольцевой метки. Вынимают пипетку из анализируемого вещества и спускают раствор до метки, держа пипетку так, чтобы метка находилась на уровне глаз. Скорость истечения жидкости из пипетки не должна превышать 1-2 мл в секунду, так как большая скорость опорожнения пипетки вызывает значительную ошибку при взятии нужного объема раствора.
Мерные цилиндры применяют для отмеривания объемов растворов вспомогательных веществ, не учитывающихся при вычислении результатов анализа.
Окрашенные жидкости готовят и отмеривают по верхнему мениску.
Бесцветные жидкости готовят и отмеривают по нижнему мениску.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|