
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Идеальный газ в молекулярно – кинетической теории. Основное уравнение молекулярно – кинетической теории газов.
Первое февраля
Классная работа
Идеальный газ в молекулярно – кинетической теории. Основное уравнение молекулярно – кинетической теории газов.
Идеальный газ – это модель МКТ, отражающая свойства реальных газов, в которой размерами молекул и их взаимодействием можно пренебречь.
Основное уравнение молекулярно –кинетической теории газов
p=  n
n 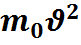
p – давление газа
n – концентрация молекул
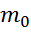 – масса молекулы
– масса молекулы
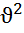 – средняя квадратичная скорость
– средняя квадратичная скорость
[p]=[ 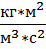 =
= 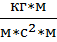 =
= 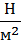 =Па]
=Па]
Связь давления газа со средней кинетической энергией молекул
p= nЕ
Е - кинетическая энергия молекул
Температура и тепловое равновесие. Абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества.
Тепловое движение – это беспорядочное движение молекул и атомов, определяющее температуру тела.
Температура тела – это физическая характеристика теплового состояния вещества, из которого состоит тело, степени его нагретости, и она определяется значением средней кинетической энергии хаотического движения частиц вещества.
Тепловое равновесие – температуры тел одинаковы.
Термометр – прибор для измерения температуры тела.
t – температура тела
[t]= [0С]
Температура может беспредельно повышаться, но в природе существует ее нижний предел – абсолютный нуль, ниже которого она не может опускаться. Существование абсолютного нуля температур было положено английским ученым У. Томсоном ( Кельвином) в основу построения абсолютной шкалы температур, которая не зависит от свойств метрического тела и поэтому может считаться идеальной.
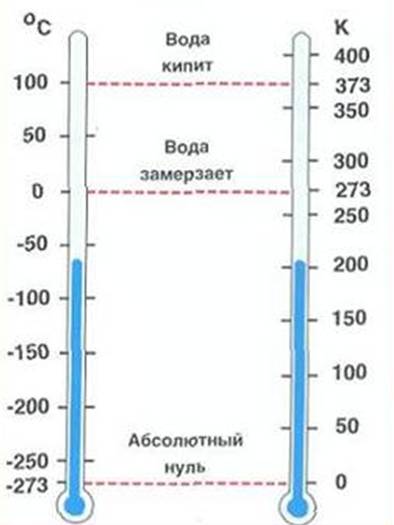
Т=t+273
Т – абсолютная температура
[Т]= [К] К – Кельвин 1 К=10С
Средняя кинетическая энергия молекул газа прямо пропорциональна его абсолютной температуре
Е = kТ
K – постоянная Больцмана
K =1, 38 *10-23Дж/К
Связь давления газа с абсолютной температурой
р =nkТ
Решить задачу: Найти температуру газа при давлении 100 кПа и концентрации молекул 1025 м-3.
Домашнее задание: чит. § 57, 59, 60, выучить формулы, решить с. 203 ЕГЭ А1, А2.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|