
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решение задач учениками.. IV. Закрепление изученного материала
Решение задач учениками.
1.

х= 20* 5654/337 = 38, 81 кДж
Ответ: 38, 81 кДж.
2. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
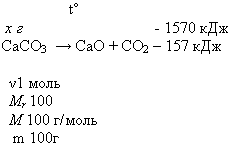
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 - 157 кДж -
х г СаСО3 - 1570 кДж
100г: 157 кДж = х г: 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV. Закрепление изученного материала
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
…. Это реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) горения;
в) эндотермические;
г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
г) H2 + O2 —> H2О + 572 кДж
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Установите соответствие между схемой реакции и её типом:
А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 – 572 кДж
1. Эндотермическая реакция
2. Экзотермическая реакция
5. Приведены уравнения реакций:
А. СаО + Н2О = Са(ОН)2
Б. 2HgO = 2Hg + O2
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические
2) обе реакции эндотермические
3) А – эндотермическая, а Б – экзотермическая
4) А – экзотермическая, а Б – эндотермическая
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|