- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ковалентная связь- это химическая связь, образованная путем обобществления пары электронов двумя атомами. Ковалентная связь бывает: полярная и неполярная
Химическая связь. Структура молекулы
Основные виды химической связи: ионная, ковалентная и металлическая
Между молекулами происходят вандерваальсовы взаимодействия и возникает водородная химическая связь
Ковалентная связь- это химическая связь, образованная путем обобществления пары электронов двумя атомами. Ковалентная связь бывает: полярная и неполярная
Механизмы образования ковалентной связи: обменный (по одному электрону от каждого атома) и донорно-акцепторный (один атом предоставляет неподеленную пару электронов (донор), а другой - вакантную орбиталь (акцептор)
Электроотрицательность (ЭО) – способность атомов в соединениях притягивать к себе электроны. Максимальное значение 4 имеет F
Валентность (В или В* ) – способность атома присоединять или замещать определенное число других атомов с образованием химических связей. Количественная мера валентности (по методу валентных связей)- число неспаренных электронов у атома в основном или в возбужденном состоянии (*).
Молекула НI 
|
Механизм образования ковалентной связи - обменный
Валентный угол 180о, структура молекулы - линейная
ЭО(Na)= 0, 9 ЭО(I)=2, 5 ∆ ЭО≠ 0 Þ
Электрический момент диполя связи не равен 0 µсв≠ 0, => связь полярная
Электрический момент диполя молекулы не равен 0 µм=∑ µсв≠ 0 => молекула полярная
Молекула ВеСl2
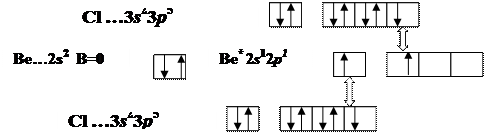
В*=2
■ sp-гибридизация АО Ве , Ð 180о
■ пространственная структура Þ линейная.
Cl Be Cl
■ ЭО Ве и Cl: 1, 5 и 3, 0 ∆ ЭО≠ 0 Þ m св ¹ 0 Þ связь полярная
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|