
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Занятие (1-2)
Занятие (1-2)
Химическая связь. кристаллическая решетка.
особенности физических свойств веществ от строения
План работы
1. Типы химической связи (ионная, металлическая, ковалентная полярная и неполярная).
2. Водородная связь – особый тип связи (на примере молекулы воды).
3. Типы кристаллических решеток.
4. Механизмы образования ковалентной связи. Выполнение д/з (задания с примерами) «Напоминалка по строению атома» https://youtu.be/kqHYbT9rv6A
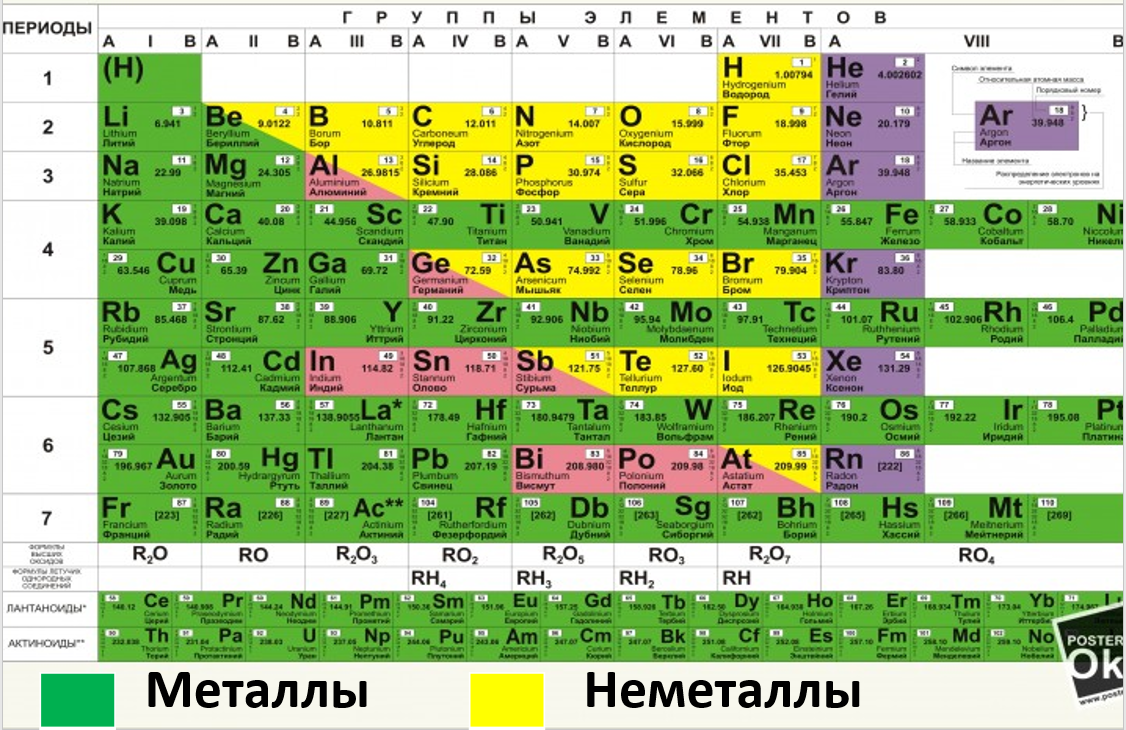
Фиолетовым цветом выделены инертные (благородные газы), их молекулы состоят только их одного атома и записываются таким образом – He, Ar.
Розовым цветом выделены элементы, которые проявляют двойственную природу (являются частично металлами и неметаллами) – вспоминаем про понятие «амфотерность». Внимание! Zn – амфотерный металла!
1. химическая связь
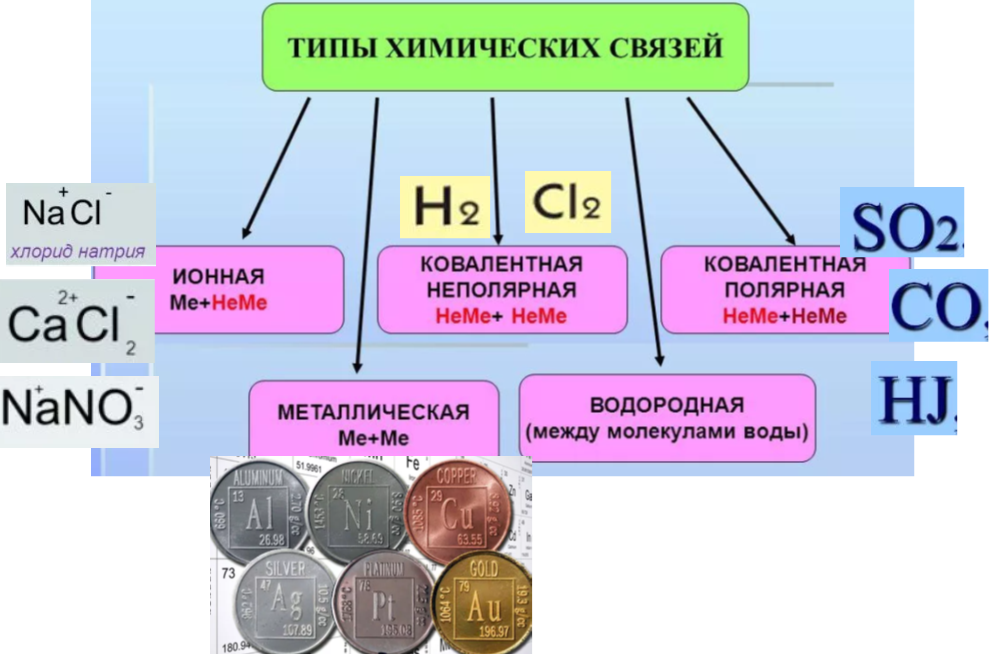 На рисунке приведена классификация видов (типов) химической связи. Именно химическая связь позволяет атомам (или ионам) в веществе «держаться вместе».
На рисунке приведена классификация видов (типов) химической связи. Именно химическая связь позволяет атомам (или ионам) в веществе «держаться вместе».
Рассмотрим более подробно особенности образования каждого типа (вида) химической связи и физический свойства веществ, которые обладают указанным типом. Не забываем, что иногда для одного соединения может быть характерно несколько типов химической связи.
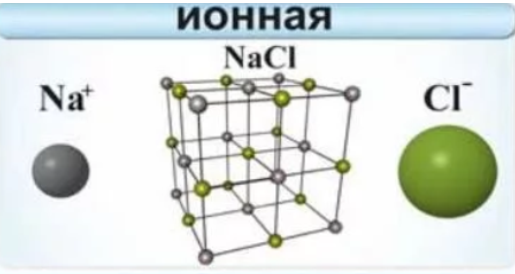 Ионная связь
Ионная связь
Данный тип связи возникает между атомами металлов и атомами неметаллов. Например, этим типом связи обладает большинство солей (NaCl, CaSO4, K3PO4), оксиды металлов (Na2O, BaO), основания, имеющие атом металла (NaOH, Ca(OH)2), многие бинарные соединения типа Li3N, CaC2, Na3P.
Вещества с данным типом связи состоят из ионов (заряженных частиц), так как электроны от металла переходят к неметаллу.
Внимание! На первый взгляд в таких веществах, как NH4+NO3-, NH4Cl, CH3NH3+Cl- нет атомов металлов, но, тем не менее, для них характерна ионная связь, между положительно заряженными ионами аммония и отрицательными ионами кислотного остатка.
Вещества с ионной химической связью относительно прочные, их расплав и водные растворы (если вещества растворимы и не подвергаются гидролизу) – хорошо проводят электрический ток. Данные вещества - хрупкие, например, представим кристаллики поваренной соли, которые можно измельчить.
Ковалентная связь
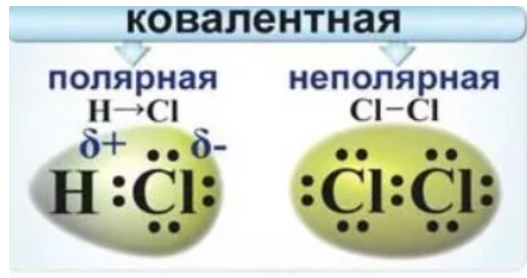 Ковалентная связь возникает между атомами неметаллов. Еслиатомы одинаковые (их электроотрицательность НЕ отличается)– этоНЕполярная ковалентная связь (обобществленные электроны равномерно на одинаковом расстоянии располагаются между атомами).
Ковалентная связь возникает между атомами неметаллов. Еслиатомы одинаковые (их электроотрицательность НЕ отличается)– этоНЕполярная ковалентная связь (обобществленные электроны равномерно на одинаковом расстоянии располагаются между атомами).
Пример: Р (фосфор), S (сера), Н2, О2 и другие неметаллы.
Еслиатомы неметаллов различны (электроотрицательность отличается)– этополярная ковалентная связь (обобществленные электроны неравномерно располагаются между атомами, а смещены в сторону БОЛЕЕ электроотрицательного элемента). Пример: H2O, NO, SO2, HBr и др.
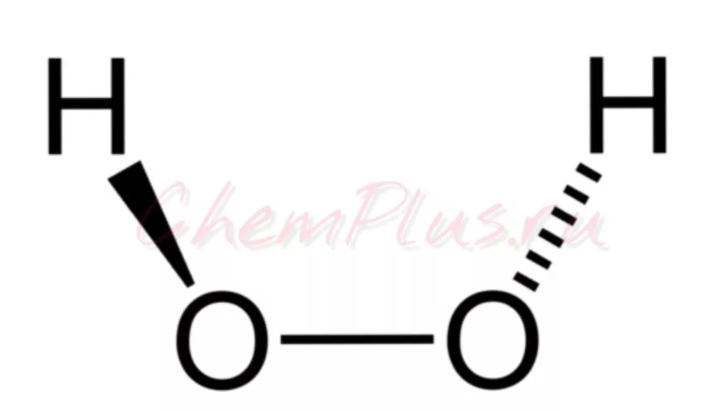 Внимание! На первый взгляд, если мы рассматриваем пероксид водорода Н2О2, то явно видим различные атомы неметаллов (О) и (Н), значит в соединении полярная химическая связь. Однако, если рассмотреть структурную формулу, видно, что в молекуле существуют связи О–О, значит характерна и неполярная ковалентная связь.
Внимание! На первый взгляд, если мы рассматриваем пероксид водорода Н2О2, то явно видим различные атомы неметаллов (О) и (Н), значит в соединении полярная химическая связь. Однако, если рассмотреть структурную формулу, видно, что в молекуле существуют связи О–О, значит характерна и неполярная ковалентная связь.
Соединения с ковалентной связью непрочные, летучие жидкости или газы. НО, есть важная особенность – здесь на прочность вещества будет влиять еще тип кристаллической (атомная или молекулярная)! Об этом речь пойдет в пункте «Кристаллические решетки».
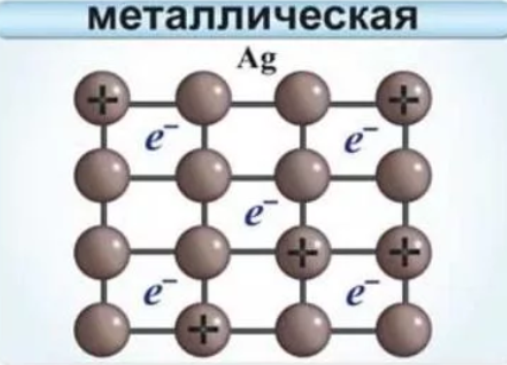 Металлическая связь
Металлическая связь
Данный тип связи возникает в простых веществах металлах (или соединениях интерметаллидах, но это не вопрос ЕГЭ), между атомами металлов, например, Na, Ag, Сu, Fe, Zn и многих других.
Именно металлический тип связи обеспечивает особые (общие) свойства металлов: металлический блеск, прочность (в некоторых случаях бывают исключения), тепло- и электропроводность, ковкость и пластичность. В узлах металлической кристаллической решетки находятся как атомы, так и ионы, а между ними перемещается некоторое количество электронов (эти электроны теряют атомы металлов, но не все). Можно встретить устаревший термин «электронный газ».
2. Водородная связь – особый тип связи
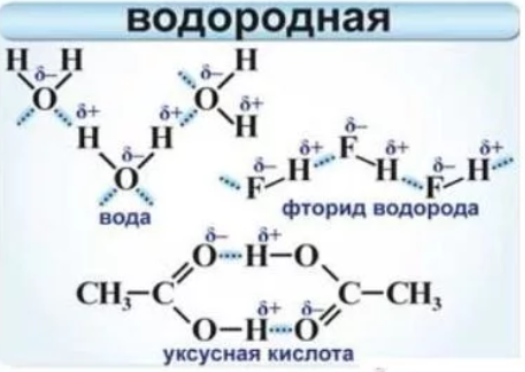 Особенность водородной связи в том, что она возникает только в том случае:
Особенность водородной связи в том, что она возникает только в том случае:
- если молекула содержит атом водородаи атом другого активного неметалла (например, F, O, N, Cl).
Водородная связь возникает МЕЖДУ молекулами и НАМНОГО слабее других типов химической связи.
Примеры соединений с водородным типом связи – вода (H2O), пероксид водорода (H2O2), аммиак (NH3), гидразин (N2H4), фтороводород (HF), некоторые органические соединения (рассматриваем в других темах).
Внимание! Водородная связь между молекулами воды (Н2О) придает воде особенные физические свойства (по сравнению с родственными ей по группе веществами – H2S, H2Se). У воды более высокие температуры кипения и плавления, вода обладает определенной плотностью и теплопроводностью. На планете Земля вода существует во всех агрегатных состояниях в небольшом интервале температур, что можно рассматривать как возможность зарождения жизни.
Если бы вода не имела водородные связи между молекулами, живые организмы не могли бы появится на планете, климат был бы другим, не могли бы возникнуть сложные органические молекулы.
Кстати, водородные связи позволяют большим органическим молекулам поддерживать свою структуру – ДНК имеет форму спирали, молекулы белком имеют очень сложные формы (третичная и четвертичная структура).
Даже для некоторых синтетических полимеров водородные связи достаточно важны. Для органических молекул водородный связи могут быть внутри молекулы.
3. Типы кристаллических решеток различных веществ
В зависимости от типа химической связи вещества обладают и различными видами (типами) кристаллических решеток. В таблице дана их характеристика и примеры.
Внимание! Для олимпиад кристаллические решётки металлов (особенности их упаковки) рассматриваются более подробно.
| Строение кристаллической решетки (рис) | Описание | Примеры веществ и их свойства |