
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
NaNO3 (aq) + 6KI(aq) + 4H2SO4 (aq) → 2NO(g) + 3I2 (s) + 3K2SO4 (aq) +Na2SO4 (aq) + 4H2O(l)
Министерство образования и науки Российской Федерации
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ
Кафедра
Неорганической химии и биофизики
Контрольная работа по дисциплине:
«Неорганическая и аналитическая химия»
Выполнила:
Бакуменко Кристина Владимировна
1 группа заочного обучения
Шифр 19901
Проверил:
Доцент кафедры неорганической химии и биофизики,
кандидат химических наук
Барышев Александр Николаевич
Дата сдачи:____________
Оценка:_______________
Г.Санкт-Петербург, 2019-2020 гг.
1.
2CuO = 2Cu+O2
M(CuO) = 80
M(CuO)=79.5*1=79.5
n(O2)=79.5/80=0.99
n(O)=0.99/2=0.495 моль
V(O)=0.495*22.4=11.1л
2. Кислоты – хим. Соединения, способные отдавать катионы водорода, либо соед., способные принимать эл. Пару с образование ковалентной связи
Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Взаимодействие кислот с основаниями. Эта реакция называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
| кислота | основание | соль | вода | |||
| H2SO4 | + | Ca(OH)2 | = | CaSO4 | + | 2 H2O |
| H3PO4 | + | Fe(OH)3 | = | FePO4 | + | 3 H2O |
| 2 H3PO4 | + | 3 Ca(OH)2 | = | Ca3(PO4)2 | + | 6 H2O |
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
| кислота | оксид | соль | вода | |||
| 2 HCl | + | CaO | = | CaCl2 | + | H2O |
| 2 H3PO4 | + | Fe2O3 | = | 2 FePO4 | + | 3 H2O |
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
| кислота | металл | соль | ||||
| HCl | + | Hg | = | не образуется | ||
| 2 HCl | 2 Na | = | 2 NaCl | + | H2 | |
| H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
{\displaystyle {\mathsf {Mg+2H_{2}SO_{4}\longrightarrow MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
3. 2S+3O2=2SO3
V1=k*[A2][B]
V2= k*[3A2][3B]=3k[A2][B]
V1/V2= 3
Скорость увеличится в 3 раза
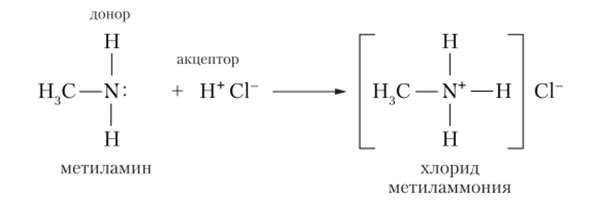
4. Донорно-акцепторная связь – перенос заряда между молекулами донора и акцептора без образования химической связи, или передача неподеленной эл. пары от донора к акцептору
Доноры – N, O, P, S
Акцепторы – H+, p-металлы, d-элементы
5. P=CRT
20º C= 293K
0.1моль/л = 0,0001 кмоль/м3
Р= 0,0001*8,3145*293= 0,2436
6. Связь между внутренне сферой и внешней – ионная, связи внутренней сферы – ковалентные.
Часть 2.
1. При диссоциации солей образуются катионы Ме и анионы кислотного остатка.
Fe(HSO4)3 <=> Fe(3+) + 3HSO4(-)
Zn(OH)2 ↔ ZnOH+ + OH-
ZnOH+ ↔ Zn2+ + OH-
HNO2 <=> H(+) + NO2(-)
2. ZnSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая ступень (стадия) гидролиза
Молекулярное уравнение
2ZnSO4 + 2HOH ⇄ (ZnOH)2SO4 + H2SO4
Полное ионное уравнение
2Zn2+ + 2SO42- + 2HOH ⇄ 2ZnOH+ + SO42- + 2H+ + SO42-
Сокращенное (краткое) ионное уравнение
Zn2+ + HOH ⇄ ZnOH+ + H+
Вторая ступень (стадия) гидролиза
Молекулярное уравнение
(ZnOH)2SO4 + 2HOH ⇄ 2Zn(OH)2 + H2SO4
Полное ионное уравнение
2ZnOH+ + SO42- + 2HOH ⇄ 2Zn(OH)2 + 2H+ + SO42-
Сокращенное (краткое) ионное уравнение
ZnOH+ + HOH ⇄ Zn(OH)2 + H+
В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7).
AlCl3 AlCl3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая ступень (стадия) гидролиза
Молекулярное уравнение
AlCl3 + HOH ⇄ AlOHCl2 + HCl
Полное ионное уравнение
Al3+ + 3Cl- + HOH ⇄ AlOH2+ + 2Cl- + H+ + Cl-
Сокращенное (краткое) ионное уравнение
Al3+ + HOH ⇄ AlOH2+ + H+
Вторая ступень (стадия) гидролиза
Молекулярное уравнение
AlOHCl2 + HOH ⇄ Al(OH)2Cl + HCl
Полное ионное уравнение
AlOH2+ + 2Cl- + HOH ⇄ Al(OH)2+ + Cl- + H+ + Cl-
Сокращенное (краткое) ионное уравнение
AlOH2+ + HOH ⇄ Al(OH)2+ + H+
Третья ступень (стадия) гидролиза
Молекулярное уравнение
Al(OH)2Cl + HOH ⇄ Al(OH)3 + HCl
Полное ионное уравнение
Al(OH)2+ + Cl- + HOH ⇄ Al(OH)3 + H+ + Cl-
Сокращенное (краткое) ионное уравнение
Al(OH)2+ + HOH ⇄ Al(OH)3 + H+
В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7).
Na2SiO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая ступень (стадия) гидролиза
Молекулярное уравнение
Na2SiO3 + HOH ⇄ NaHSiO3 + NaOH
Полное ионное уравнение
2Na+ + SiO32- + HOH ⇄ Na+ + HSiO3- + Na+ + OH-
Сокращенное (краткое) ионное уравнение
SiO32- + HOH ⇄ HSiO3- + OH-
Вторая ступень (стадия) гидролиза
Молекулярное уравнение
NaHSiO3 + HOH ⇄ H2SiO3 + NaOH
Полное ионное уравнение
Na+ + HSiO3- + HOH ⇄ H2SiO3 + Na+ + OH-
Сокращенное (краткое) ионное уравнение
HSiO3- + HOH ⇄ H2SiO3 + OH-
В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7).
K2Se — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая ступень (стадия) гидролиза
Молекулярное уравнение
K2Se + HOH ⇄ KHSe + KOH
Полное ионное уравнение
2K+ + Se2- + HOH ⇄ K+ + HSe- + K+ + OH-
Сокращенное (краткое) ионное уравнение
Se2- + HOH ⇄ HSe- + OH-
Вторая ступень (стадия) гидролиза
Молекулярное уравнение
KHSe + HOH ⇄ H2Se + KOH
Полное ионное уравнение
K+ + HSe- + HOH ⇄ H2Se + K+ + OH-
Сокращенное (краткое) ионное уравнение
HSe- + HOH ⇄ H2Se + OH-
В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7).
3. 10 FeSO4 + 2 KMnO4 + 8 H2SO4 → 5 Fe2[SO4]3 + 2 MnSO4 + K2SO4 + 8 H2O
2 MnVII + 10 e- → 2 MnII (восстановле́ние)
10 FeII - 10 e- → 10 FeIII (окисление)
2NaNO3 (aq) + 6KI(aq) + 4H2SO4 (aq) → 2NO(g) + 3I2 (s) + 3K2SO4 (aq) +Na2SO4 (aq) + 4H2O(l)
6 I-I - 6 e- → 6 I0 (окисление)
2 NV + 6 e- → 2 NII (восстановле́ние)
4. m(KOH)= C*V*Mэ/1000=0,05*10*56/1000=0,028
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|