
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Изучение нового материала.. Кристаллические тела
Изучение нового материала.
1. Кристаллические тела
Твёрдые тела – тела, которые со временем не меняют своей формы и объёма. Твёрдые тела делятся на…
1. Кристаллы (кристаллические тела).
2. Аморфные тела.


Рис. 1. Примеры кристаллических (соль) и аморфных (воск) твёрдых тел соответственно.
Кристаллы– твёрдые тела, у которых наблюдается упорядоченное расположение атомов или молекул (рис. 2).
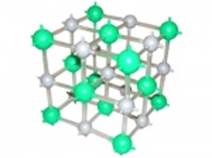 Рис. 2. Пример кристаллической решётки (каменная соль.
Рис. 2. Пример кристаллической решётки (каменная соль.
Кристаллы, в свою очередь, также делятся на два класса:
1. Монокристаллы, то есть вся структура тела представлена единым кристаллом.
 Рис.3 Монокристаллы
Рис.3 Монокристаллы
2. Поликристаллы, то есть структура тела представляет собой объёдинение большого количества малых кристаллов (гранит, большинство металлов…) В природе наиболее распространены поликристаллы. Почти все металлы являются поликристаллами (рис.4).
 Рис. 4. Поликристаллы
Рис. 4. Поликристаллы
Полиморфизм– свойство твёрдых тел существовать в состоянии с различной кристаллической решёткой. Например, алмаз и графит оба состоят из углерода, однако с различным расположением его атомов.
Кристаллы могут быть распределены на две группы также и по следующим свойствам: изотропия и анизотропия.
Анизотропия– зависимость физических свойств кристалла от направления. То есть кристаллическая структура не симметрична, и существует несколько осей, вдоль которых у кристалла проявляются различные свойства (механические, электрические, оптические). Анизотропия свойственна монокристаллам. Пожалуй, один из самых наглядных примеров проявления анизотропии — это графит. Когда вы пишете, его слои остаются на бумаге. На это не нужно затрачивать много усилий. Однако сломать графит поперек слоев довольно сложно. Конечно, карандаш ломается достаточно легко только потому, что стержень графита в нем довольно тонкий. Если мы рассмотрим кристаллическую решетку графита, то убедимся, что она имеет слоистую структуру.
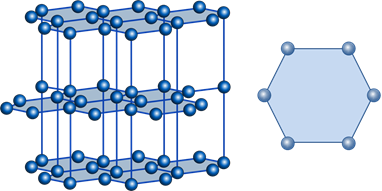 Рис.5 . Кристаллическая решетка углерода
Рис.5 . Кристаллическая решетка углерода
Атомы углерода образуют правильные шестиугольники, и связи между этими шестиугольниками значительно прочнее, чем связи между слоями. Дело в том, что расстояние между слоями приблизительно вдвое больше (рис.5), чем сторона шестиугольника.
Изотропия – независимость физических свойств кристалла от направления. Свойственна поликристаллам, потому как несимметрические монокристаллы ориентируются хаотически, сводя на нет несимметричность.
Ещё одним принципом, по которому можно классифицировать кристаллы, является природа связей, которые удерживают узлы кристаллической решётки вместе:
1. Молекулярные кристаллы — это кристаллы, образованные из молекул. Как правило, такие кристаллы являются наименее прочными и имеют достаточно низкую температуру плавления. Например, молекулярные кристаллы образуются из водорода или гелия.
2. Ковалентные кристаллы — кристаллы, образованные посредством ковалентной связи. Ковалентные кристаллы, напротив, достаточно прочны и имеют высокую температуру плавления. Примерами ковалентных кристаллов могут послужить алмаз, германий или кремний.
3. Ионныекристаллы — это кристаллы, образующиеся за счет ионной связи, то есть связи посредством электростатического притяжения. Самым распространенным примером ионного кристалла является поваренная соль, которая состоит из ионов натрия и хлора.
4.Металлические кристаллы — это кристаллы, образующиеся за счет металлических связей. К таким кристаллам относятся все металлы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|