
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
Стр 1 из 3Следующая ⇒
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
количественный метод
 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)

 m(CаO)=?
m(CаO)=?
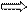 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль





 1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|