
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Пример 2.. Пример 3.. Пример 4.. Пример 5.
Реакции ионного обмена.
Закончить уравнения реакций ионного обмена (внимание, идут не все реакции!)у вас должно быть записано к каждому уравнению :молекулярное уравнение, полное ионное и сокращенное ионное уравнение.
Задание: Выбираете три уравнения и записываете ТОЛЬКО УРАВНЕНИЯ В ТРЕХ ВИДАХ, словами НИ ЧЕГО НЕ ПИШЕМ(как в примере 2,3,4,5)
Образец: реакций ионного обмена составляютполные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают :
- нерастворимые вещества (см. таблицу растворимости);
- оксиды;
- воду;
- газы
1) Запишеммолекулярное уравнениеи уравняем его:
CuSO4 + 2NaOH 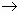 Na2SO4 + Cu(OH)2
Na2SO4 + Cu(OH)2 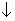
2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения:
Cu+2 + SO4-2 + 2Na+1 + 2OH-1 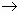 2Na+1 + SO4-2 + Cu(OH)2
2Na+1 + SO4-2 + Cu(OH)2 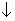 (полное ионное уравнение)
(полное ионное уравнение)
3) Запишем то, что получилось:
Cu+2 + 2OH-1 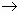 Cu(OH)2
Cu(OH)2 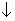 (сокращенное ионное уравнение)
(сокращенное ионное уравнение)
Другие примеры составления ионных уравнений (разбираются с пояснениями):
Пример 2.
CaCO3 + 2HNO3 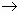 Ca(NO3)2 + H2CO3 (H2O + CO2
Ca(NO3)2 + H2CO3 (H2O + CO2 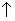 )
)
CaCO3 + 2H+1 + 2NO3-1 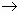 Ca+2 + 2NO3-1 + H2O + CO2
Ca+2 + 2NO3-1 + H2O + CO2 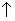
CaCO3 + 2H+1 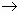 Ca+2 + H2O + CO2
Ca+2 + H2O + CO2 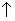
Пример 3.
CuS + 2HCl  CuCl2 + H2S
CuCl2 + H2S 
CuS + 2H+1 + 2Cl-1  Cu+2 + 2Cl-1 + H2S
Cu+2 + 2Cl-1 + H2S 
CuS + 2H+1 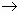 Cu+2 + H2S
Cu+2 + H2S 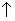
Пример 4.
NaOH + HNO3 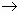 NaNO3 + H2O
NaNO3 + H2O
Na+1 + OH-1 + H+1 + NO3-1 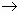 Na+1 + NO3-1 + H2O
Na+1 + NO3-1 + H2O
OH-1 + H+1 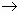 H2O
H2O
Пример 5.
K3PO4 + 3NaCl 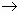 Na3PO4 + 3KCl
Na3PO4 + 3KCl
3K+1 + PO4-3 + 3Na+1 + 3Cl-1 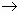 3Na+1 + PO4-3 + 3K+1 + 3Cl-1
3Na+1 + PO4-3 + 3K+1 + 3Cl-1
Вывод: сокращенного ионного уравнения нет, следовательно, у обратимых реакций нет сокращенных ионных уравнений
ЗАДАНИЯ выполнить до 15.11
MgCl2 + AgNO3 →
ZnSO4 + Ba(NO3)2 →
K2SO3 + H3PO4 →
CaSO4 + BaCl2 →
NaOH + ZnCl2 →
Li2SO4 + CuCl2 →
NH4NO3 + KOH →
MgO+HCl →
Ba(OH)2 + SO3→
BaCl2 + HCl →
NH4Br + AgNO3 →
Cu(NO3)2 + Rb2S →
(NH4)2SO4 + NaCl→
CaCO3 + H2O + CO2 →
HCl + NaOH →
H2SiO3 + NaOH →
MnHPO4 + NaOH →
Na2SO4 + H2SO4 →
Fe(NO3)2 + K2S→
NaHCO3 + NaOH →
KCl + ….. → KNO3 + ……
ZnSO4 + …… → ZnCl2 + …..
Ba(NO3)2 + ….. → KNO3 + …..
LiCl + ….. → NaCl + …..
HCl + ….. → CO2 + H2O + …
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|