
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
II. Расчет рН
II. Расчет рН
1. Какое количество вещества HAn надо прибавить к V л сc М раствору NaAn, чтобы раствор стал нейтральным (константа диссоциации кислоты равна Кд)?
2. Сколько г кислоты HAn надо прибавить к V мл сc М раствору NaAn, чтобы раствор стал нейтральным (константа диссоциации кислоты равна Кд)?
3. Найти концентрацию ОН– в крови человека (водородный показатель крови равен рН) при t °C, если ионное произведение воды при при t °C равно Кw.
4. Концентрация угольной кислоты в плазме крови равна ск ммоль/л. Какова концентрация гидрокарбонат-ионов, если водородный показатель крови равен рН?
5. Водородный показатель раствора кислоты А (константа диссоциации кислоты равна Кд) равен рН. Найти молярную концентрацию кислоты в этом растворе.
6. Водородный показатель ω %-ного раствора слабого основания А (молярная масса М г/моль) равен рН. Найти константу диссоциации А.
7. Найти водородный показатель ω %-ного раствора кислоты А (молярная масса М г/моль; константа диссоциации кислоты равна Кд).
8. m г кислоты А (молярная масса М г/моль; константа диссоциации кислоты равна Кд) растворили в V мл воды. Найти рН раствора.
9. Найти рН с М раствора кислоты А (константа диссоциации кислоты равна Кд).
10. Найти рН ω %-ного раствора основания А (константа диссоциации равна 1,8·10–5; плотность раствора ρ г/мл).
11. Найти рН ω %-ного раствора однокислотной щелочи (плотность раствора ρ г/мл).
12. Найти рН с М раствора двухкислотной щелочи.
13. Водородный показатель раствора щелочи MOH (плотность раствора ρ г/мл) равен pH. Найти массовую долю щелочи в этом растворе.
14. Найти рН раствора NaOH, V л которого содержит m г щелочи.
15. Найти рН ω %-ного раствора HCl.
16. Как изменится рН при добавлении V1 мл сэкв. н. раствора щелочи к V2 мл воды?
17. К V1 мл с М раствора сильной кислоты HAn прибавили V2 мл ω %-ного раствора NaOH (плотность раствора ρ г/мл). Найти рН полученного раствора.
18. Имеются два раствора со значениями водородного показателя рН1 и рН2. В каком из растворов равновесная концентрация ионов H⁺ больше и во сколько раз?
19. Каково отношение концентраций ионов НСО  и СО₂ в крови, если водородный показатель равен рН (показатель константы диссоциации равен pK)?
и СО₂ в крови, если водородный показатель равен рН (показатель константы диссоциации равен pK)?
20. Какова величина рН в клетках, если в норме 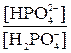 в них равно x (показатель константы диссоциации равен pK)?
в них равно x (показатель константы диссоциации равен pK)?
21. Найти рН c M раствора соли слабой кислоты, если константа диссоциации кислоты равна Кд.
22. Найти рН c M раствора соли слабого основания, если константа диссоциации основания равна Кд.
23. Водородный показатель раствора KAn равен рН (константа диссоциации кислоты HAn равна Кд). Какова молярная концентрация соли?
24. Водородный показатель раствора соли слабого основания равен рН (константа диссоциации основания равна Кд). Какова молярная концентрация соли?
25. Найти рН c М раствора K2An (константа второй ступени диссоциации кислоты H2An равна Кд,II). Как подавить гидролиз этой соли?
26. Найти рН раствора, состоящего из m1 г соли KAn и m2 г воды (плотность раствора ρ г/мл; константа диссоциации кислоты HAn равна Кд).
27. Найти рН ω %-ного раствора соли KAn (константа диссоциации кислоты HAn равна Кд).
28. Какова концентрация ионов An– и рОН в c М растворе HAn (константа диссоциации кислоты HAn равна Кд)?
29. Найти pH буферного раствора, приготовленного из V1 мл сэкв,1н. раствора кислоты (показатель константы диссоциации равен рК) и V2 мл сэкв,2н. раствора натриевой соли этой кислоты.
30. Найти pH буферного раствора, приготовленного из V1 мл сэкв,1н. раствора основания (показатель константы диссоциации равен рК) и V2 мл сэкв,2н. раствора соли этого основания.
31. Найдите отношение равновесных концентраций гидроортофосфат-ионов и дигидроортофосфат-ионов в плазме крови, если водородный показатель равен pH. Показатель константы диссоциации дигидроортофосфат-ионов примите равным рК .
32. Как изменится рН фосфатного буферного раствора (константа второй ступени диссоциации кислоты равна Кд,II), содержащего V1 мл сэкв,1н. раствора KH₂PO₄ и V2 мл сэкв,2н. раствора Na₂HPO₄, при добавлении V3 мл сэкв,3н. раствора щелочи?
33. Как изменится рН кислотной буферной смеси, состоящей из V1 мл сэкв,1н. раствора кислоты (показатель константы диссоциации равен рК) и V2 мл сэкв,2н. раствора натриевой соли этой кислоты, при добавлении V3 мл сэкв,3н. раствора щелочи?
34. В каком соотношении надо смешать c1 М раствор KtOH и c2 М раствор KtCl, чтобы получить раствор, водородный показатель которого равен рН (константа диссоциации слабого основания равна Кд)?
35. Найти соотношение компонентов буферной смеси (показатель константы диссоциации кислоты равен рК), если используют растворы кислоты и соли одинаковой концентрации, а водородный показатель равен рН.
36. Найдите объемы растворов слабого основания (показатель константы диссоциации равен pK) и его соли с одинаковыми молярными концентрациями эквивалентов, необходимых для приготовления V мл буферного раствора с водородным показателем, равным рН.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|