
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ОПОРНЫЙ КОНСПЕКТ № 1. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. А.М. БУТЛЕРОВА
ОПОРНЫЙ КОНСПЕКТ № 1
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А.М. БУТЛЕРОВА
Теория химического строения органических соединений раскрывает закономерности и порядок связи атомов друг с другом в молекулах. Разработана А.М. Бутлеровым в 1861г.
Основные положения теории.
- Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен.
Формулы строения:
а) структурная формула - описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными).
Например, полная и сокращенная структурные формулы н-бутана C4H10 имеют вид:
Н Н Н Н
׀ ׀ ׀ ׀
Н – С – С – С – С – Н СН3 – СН2 – СН2 – СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
- Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н – С – С – С – С – Н Н – С – С – С – Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н - С -Н
׀
н-бутан Н изо-бутан
2.1. Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов, обусловливает явление изомерии.
2.2. Вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства называются изомерами.
2.3. Существует два основных типа изомерии – структурная и пространственная.
2.4. Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
· вид изомерии, связанный с изменение строения углеродной цепи, называется изомерией углеродного скелета (изомерией цепи). Например, пентан имеет следующие изомеры:
С
׀
С – С – С – С – С С - С – С – С С - С – С
׀ ׀
С С
н-пентан, Tкип.= +36°С 2-метилбутан, Ткип.= +27°С 2,2 –диметилпропан, Ткип.= +5°С
· вид изомерии, связанный с изменением места расположения кратной связи и /или атомов и групп атомов (галогенов, гидроксо-, нитрогрупп и др.), заместивших атомы водорода в углеродной цепи, называется изомерией положения. Например,
СН3 - СН2 – СН = СН2 и СН3 - СН = СН – СН
бутен-1 бутен-2
СН3 - СН2 – СН2-ОН и СН3 - СН – СН3
пропанол-1 ׀
ОН пропанол-2
· межклассовая изомерия. Изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О:
СН3 - СН2 - ОН СН3 - О - СН3
спирт Tкип.= +78,4°С эфир Tкип.= -23,7°С
2.5.Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве.
Пространственная изомерия подразделяется на: а)геометрическую (цис- и транс-изомерию), она возможна при наличии двойной связи в корне молекулы:
СН3 СН3 СН3 Н
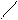
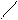
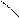
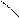
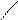
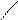 С = С С = С
С = С С = С
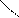 |  |
Н Н Н СН3
цис-изомер транс-изомер
б)Оптическая (зерккальная), она возможна при наличии ассиметричного атома углерода (при атоме углерода 4 разных заместителя)
- Молекула каждого вещества обладает определенным химическим строением, которое может быть установлено химическими методами. Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы - предвидеть свойства вещества.
- Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.
Теория Бутлерова явилась научным фундаментом органической химии и
способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|