
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Цвет изумруда


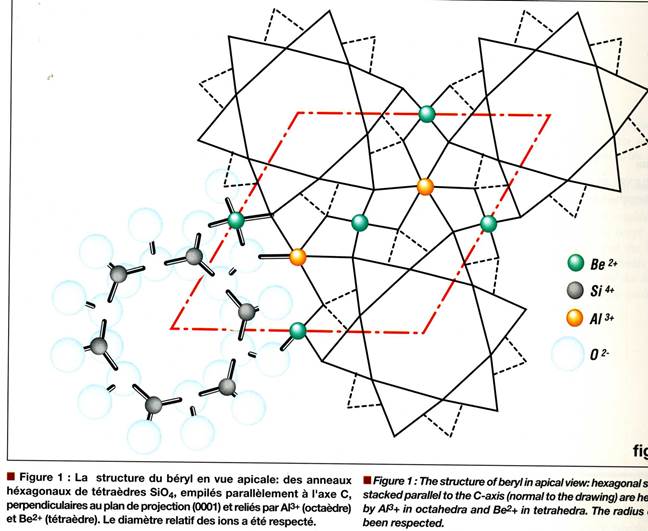
 Структура берилла вид сверху. Гексагональные кольца тетраэдров SiO4 образуют вертикальную вытянутую по оси c (перпендикулярно (0001)) структуру и связаны воедино Al3+ в октаэдрической координации и Be2+ в тетраэдрической координации.
Структура берилла вид сверху. Гексагональные кольца тетраэдров SiO4 образуют вертикальную вытянутую по оси c (перпендикулярно (0001)) структуру и связаны воедино Al3+ в октаэдрической координации и Be2+ в тетраэдрической координации.
Béryl Al2Be3[Si6O18]
Изоморфизм
2Be2+ ← Si4+ + Li+
Al3+ ← Mg2+ Fe2+ Mn2+ Fe3+ Cr3+ Ti4+ V3+
Кремнекислородные тетраэдры насыщены Si4+
Если устанавливается избыток Si4+, то это может объясняться замещением
3Be2+ (0,35 Ǻ)← Si4+ (0,42 Ǻ) , 2Li+ (0,68 Ǻ).
Анализы свидетельствуют о частом дефиците Ве в сравнении с теоретической формулой 3Ве. Частично это объясняется замещением 2Be2+ (0,35 Ǻ)← Si4+ (0,42 Ǻ). Но корреляция Ве/ Li+ свидетельствует об этом изоморфизма, несмотря на существенные различия в размерах: Be2+ (0,35 Ǻ)← Li+ (0,68 Ǻ). Этот тип замещения чувствителен к Р/Т условиям и характерен для бериллов тетраэдрического типа.
Алюмокислородные октаэдры служат ареной широкого изоморфизма:
Al3+ ← Mg2+ Fe2+ Mn2+ Fe3+ Cr3+ Ti4+ V3+
Октаэдрические замещения позволяют говорить о бериллах октаэдрического типа.
Изоморфизм Al3+ ← Cr3+ V3+ в алюмокислородных октаэдрах с повышением Т, Р снижается, повышение давления способствует замещению тетраэдрического типа Be2+ (0,35 Ǻ)← Li+ (0,68 Ǻ).
Параметр с коррелирует напрямую с размером тетраэдра ВеО4, (который изменяется вследствие изоморфизма), в то время как параметр а зависит от октаэдрического замещения.
Следовательно, отношение с/а варьирует в зависимости от типа изоморфного замещения.
0,991- 0,997 – октаэдрические бериллы
1,000 – 1,003 – тетраэдрические бериллы
0,997- 0,999 – нормальные бериллы
Щелочные ионы (прежде всего Na и Cs), реже Rb и K, входят в структуру берилла, чтобы скомпенсировать дефицит заряда, возникающего вследствие октаэдрического (Al3+ ← Mg2+ Fe2+ Mn2+) и тетраэдрического (Be2+← Li+) замещений. Это крупные ионы и они не могут найти места в структуре берилла нигде, кроме как структурных каналах.
Амбрустер (1988) рассматривает эти катионы в качестве необходимых партнёров в двойном замещении:
Na+ +Be2+ ↔Al3+
Na+ + Li+↔ Mg2+ Fe2+
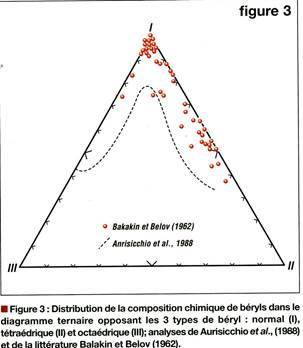
Aurisichio показал, что природные бериллы могут быть представлены как твёрдый раствор в виде тройной системы
I. Al2Be3Si6O18 – стехиометрический берилл
II. Rf (AlMe2+)Be3Si6O18.n H2O – октаэдрический берилл
III. Rf Al2BeLiSi6O18.n H2O – тетраэдрический берилл
Или в общем виде:
Rfx+y Al2-xMexBe3-yLiySi6O18.n H2O
Где Rf соответствует щелочным катионам, располагающимся в открытых каналах.
Максимально возможное количество щелочей в позиции 2b находится в пределах
0 < x + y <1
0< n<2-x-y,
при этом
n - чаще всего в пределах 0,3-0,6; x+y>0,5
Штаатц полагает, что состав берилла отражает степень дифференциации гранитных пегматитов.
Цвет изумруда
Al3+ ← Fe2+ Fe3+ Cr3+ V3+
Длина связи Al – O в бериллах 1,903 Ǻ
Cr – O в изумрудах 1,972 Ǻ
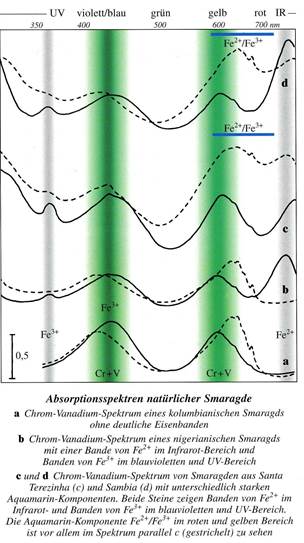
Следовательно, кристаллическое поле вокруг Cr3+ слабее, что приводит к его искажению и усилению абсорбции света. Периферические электроны атома хрома вследствие смены орбиталей избирательно поглощают световые лучи, соответствующие длине волны фиолетового, жёлтого и красного цветов (с удвоением спектра красного 6800-6830 Ǻ), в результате в остатке – голубой и зелёный – соответствуют окнам пропускания для изумруда. Результирующий зелёный цвет очень чувствителен для восприятия зрением, частично он дополнен лёгкой флюоресценцией в красном свете.
 Полосы пропускания соответствующие V3+ усиливают эффект, обусловленный Cr3+.
Полосы пропускания соответствующие V3+ усиливают эффект, обусловленный Cr3+.
Рис. Распределение природных бериллов по соотношению их типовых составов в координатах I/II/III
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|