
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Fe(OH)2 + 2Н+ → Fe2+ + 2H2O
Соединения железа
Ключевые слова конспекта: соединения железа (II), cоединения железа (III), железный купорос, соль Мора, гидрооксид железа, ферриты, оксид железа, полигидрат оксида.
СОЕДИНЕНИЯ ЖЕЛЕЗА (II)
Наиболее распространёнными соединениями железа (II) являются его соли:
· FeSO4 7H2O – сульфат железа (II) гептагидрат – железный купорос;
· FeSO4 (NH4)2SO4 • 6H2O – сульфат диаммония – железа (II) гексагидрат, соль Мора;
· FeCl2 4H2O – хлорид железа (II) тетрагидрат.
Гидратированные соли железа (II) обычно имеют бледно–зелёную окраску, безводные – бесцветны. Соли железа (II) чаще всего получают при взаимодействии железа с кислотами:
Fe + 2НCl = FeCl2 + H2↑
или в результате восстановления соединений железа (III): 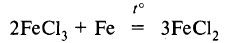
| Скидка 35% на все в Ангстрем!angstrem-mebel.ruПродавец: Мебельный холдинг «Ангстрем». Адрес: Россия, Воронеж, Торпедо, 43. ОГРН: 1073668007269₽ | Цифровые лаборатории Releonrl.ru | Учитель технологии - профессияучитель-технологии.маэо.рф |
Соединения железа (II) обладают хорошей восстановительной способностью, поэтому они удобны для использования в этом качестве в водных растворах.
Гидроксид железа (II) Fe(OH)2– белое (иногда с зеленоватым оттенком), нерастворимое в воде вещество. Легко окисляется на воздухе, особенно в присутствии влаги: 
Хотя гидроксид железа (II) и проявляет амфотерные свойства, основные свойства существенно преобладают. Так, гидроксид железа (III) реагирует с кислотами:
Fe(OH)2 + 2Н+ → Fe2+ + 2H2O
СОЕДИНЕНИЯ ЖЕЛЕЗА (III)
Соединения железа (III) получают действием сильных окислителей на металлическое железо или на соединения железа (II): 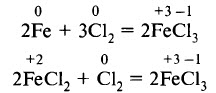
Соли железа (III) могут выступать в роли окислителей. Например: 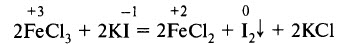
Одной из качественных реакций на ион Fe3+ является взаимодействие с роданидом калия (натрия, аммония). Признаком реакции служит образование кроваво–красного раствора роданида железа (III): 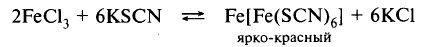
Оксид железа (III) Fe2O3 – красно-коричневый или тёмно-коричневый порошок. Оксид железа (III) хотя и проявляет амфотерность и реагирует с кислотами, а со щелочами реагирует при сплавлении:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|