
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
EJERCICIOS RESUELTOS. QUE HAN SIDO PROPUESTOS EN LOS EXБMENES DE. LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS. EN LA COMUNIDAD DE MADRID. DOMINGO A. GARCНA FERNБNDEZ. Cuestiones
QUНMICA
de
2є de BACHILLERATO
| EL ENLACE QUНMICO |
EJERCICIOS RESUELTOS
QUE HAN SIDO PROPUESTOS EN LOS EXБMENES DE
LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS
EN LA COMUNIDAD DE MADRID
(1996 − 2011)
DOMINGO A. GARCНA FERNБNDEZ
DEPARTAMENTO DE FНSICA Y QUНMICA
I.E.S. EMILIO CASTELAR
MADRID
Este volumen comprende 35 ejercicios -34 cuestiones y una pregunta- resueltos de ENLACE QUНMICO que han sido propuestos en 33 exбmenes de Quнmica de las Pruebas de acceso a estudios universitarios en la Comunidad de Madrid entre los aсos 1996 y 2011, en las siguientes convocatorias:
| AСO | E X A M E N | ||||||
| Modelo | JUNIO | SEPTIEMBRE | |||||
| Cuestiones | Problemas | Cuestiones | Problemas | Cuestiones | Problemas | ||
| Fase General |
| ||||||
| Fase Especнfica | |||||||
| Coincidencia | |||||||
|
|
| ||||||
Para poder acceder directamente a la resoluciуn de un ejercicio hay que colocarse en la fecha que aparece despuйs de su enunciado y, una vez allн, pulsar: CTRL + “CLIC” con el ratуn.
Pбgina 2
ENUNCIADOS
Cuestiones
1 − La configuraciуn electrуnica de un elemento:
a) їPermite conocer cuбl es su situaciуn en el Sistema Periуdico?.
b) їIndica quй clase de enlaces puede formar con otros elementos?.
c) їEs suficiente informaciуn para saber si el elemento es sуlido, lнquido o gas?.
d) їSirve para conocer si el elemento es o no molecular?.
Justifique las respuestas.
Septiembre 1998
2 − Considere los elementos: A (Z = 12) y B (Z = 17). Conteste razonadamente:
a) їCuбles son las configuraciones electrуnicas de A y de B?.
b) їCuбl es el grupo, el perнodo, el nombre y el sнmbolo de cada uno de los elementos?.
c) їCuбl tendrб mayor su primera energнa de ionizaciуn?.
d) їQuй tipo de enlace se puede formar entre A y B?. їCuбl serб la fуrmula del compuesto resultante?. їSerб soluble en agua?.
Septiembre 2009
3 − Considerando el elemento alcalinotйrreo del tercer perнodo y el segundo elemento del grupo de los halуgenos:
a) Escriba sus configuraciones electrуnicas.
b) Escriba los cuatro nъmeros cuбnticos posibles para el ъltimo electrуn de cada elemento.
c) їQuй tipo de enlace corresponde a la uniуn quнmica de estos dos elementos entre sн?. Razone su respuesta.
d) Indique los nombres y sнmbolos de ambos elementos y escriba la fуrmula del compuesto que forman.
Septiembre 2010 (Fase General)
4 − El elemento de nъmero atуmico 12 se combina fбcilmente con el elemento de nъmero atуmico 17. Indique:
a) La configuraciуn electrуnica de los dos elementos en su estado fundamental.
b) El grupo y perнodo al que pertenece cada uno.
c) El nombre y sнmbolo de dichos elementos y del compuesto que pueden formar.
d) El tipo de enlace y dos propiedades del compuesto formado.
Junio 2010 (Fase General)
5 − Dados los elementos A, B y C, de nъmeros atуmicos: 6, 11 y 17, respectivamente, indique:
a) La configuraciуn electrуnica de cada uno de ellos.
b) Su situaciуn en la Tabla Periуdica (grupo y perнodo).
c) El orden decreciente de electronegatividad.
d) Las fуrmulas de los compuestos formados por C con cada uno de los otros dos: A y B, y el tipo de enlace que presentan al unirse.
Modelo 2005
Pбgina 3
Ejercicios de acceso a la Universidad − Cuestiones de Enlace quнmico
6 − Cuatro elementos diferentes: A, B, C y D tienen nъmero atуmico: 6, 9, 13 y 19, respectivamente. Se desea saber:
a) El nъmero de electrones de valencia de cada uno de ellos.
b) Su clasificaciуn en metales y no metales.
c) La fуrmula de los compuestos que B puede formar con los demбs, ordenбndolos del mбs iуnico al mбs covalente.
Septiembre 1997
7 − Sabiendo que las temperaturas: 3.550 єC, 650 єC, −107 єC y −196 єC corresponden a las temperaturas de fusiуn de las sustancias: nitrуgeno, aluminio, diamante y tricloruro de boro:
a) Asigne a cada sustancia el valor que le corresponde a su temperatura de fusiуn y justifique esta asignaciуn.
b) Justifique los tipos de enlace y/o fuerzas intermoleculares que estбn presentes en cada una de las sustancias cuando se encuentran en estado sуlido.
Septiembre 2003
8 − Dados los siguientes elementos: flъor, helio, sodio, calcio y oxнgeno:
a) Justifique en funciуn de los posibles enlaces entre бtomos cuбles forman molйculas homonucleares y cuбles no, asн como su estado de agregaciуn en condiciones normales de presiуn y temperatura.
b) Formule cuatro de los compuestos diatуmicos que puedan formar entre sн, indicando la naturaleza del enlace formado.
Septiembre 1999
9 − Explique:
a) Si las estructuras de Lewis justifican la forma geomйtrica de las molйculas o si йsta se debe determinar experimentalmente para poder proponer la representaciуn correcta.
b) Si cada molйcula se representa en todos los casos por una ъnica fуrmula estructural.
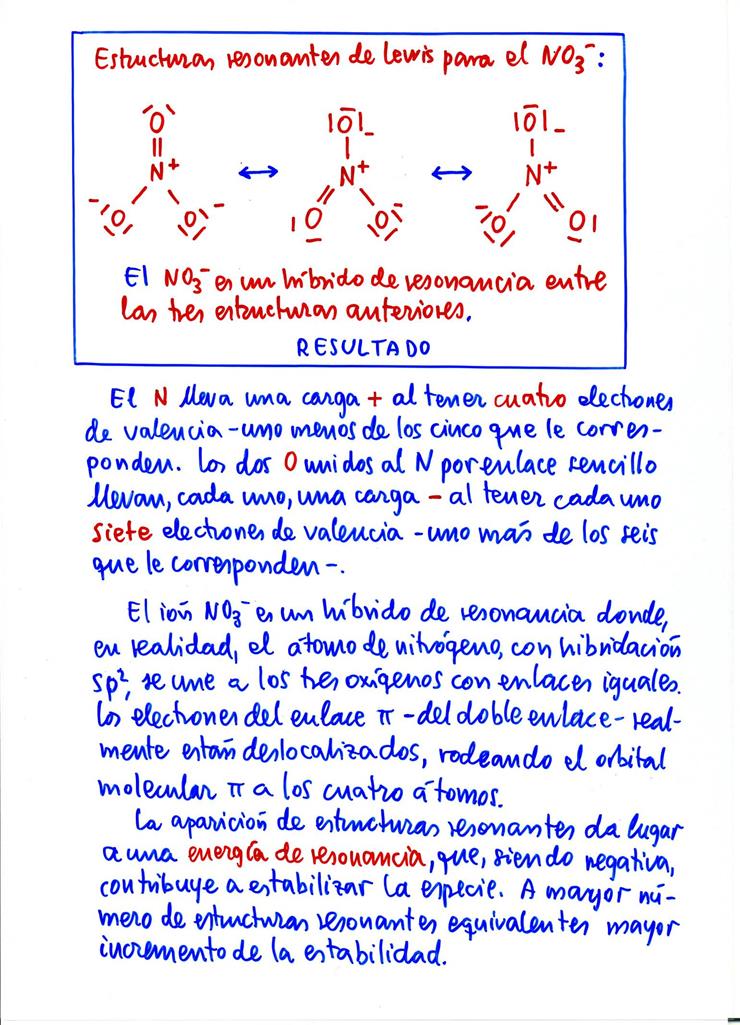
c) Representar las estructuras de Lewis de las siguientes especies: H2O y NO3− .
d) їJustifican las representaciones de las molйculas anteriores la estabilidad de las mismas?.
Junio 1997
10 − Dadas las molйculas: HCl , KF y CH2Cl2:
a) Razone el tipo de enlace presente en cada una de ellas utilizando los datos de electronegatividad.
b) Escriba la estructura de Lewis y justifique la geometrнa de las molйculas que tienen enlaces covalentes.
Datos: Valores de electronegatividad: K = 0,8 , H = 2,1 , C = 2,5 , Cl = 3,0 , F = 4,0 .
Junio 2004
Pбgina 4
Ejercicios de acceso a la Universidad − Cuestiones de Enlace quнmico
11 − a) Ordene segъn polaridad creciente, basбndose en los valores de las electronegati- vidades de la tabla adjunta, los enlaces siguientes: H−F , H−O , H−N , H−C , C−O y C−Cl.
| Elemento | F | O | Cl | N | C | S | H |
| Electronegatividad | 4,0 | 3,5 | 3,0 | 3,0 | 2,5 | 2,5 | 2,1 |
b) La polaridad de la molйcula de CH4, їserб igual o distinta que la del CCl4?.
Junio 1998
12 − Considere los compuestos: BaO , HBr , MgF2 y CCl4 .
a) Indique su nombre.
b) Razone el tipo de enlace que posee cada uno.
c) Explique la geometrнa de la molйcula CCl4 .
d) Justifique la solubilidad en agua de los compuestos que tienen enlace covalente.
Septiembre 2005
13 − Considere las sustancias: cloruro de potasio, agua, cloro y sodio.
a) Indique el tipo de enlace que presenta cada una de ellas.
b) Escriba las configuraciones de Lewis de aquellas que sean covalentes.
c) Justifique la polaridad del enlace en las molйculas covalentes.
d) Justifique la geometrнa y el momento dipolar de la molйcula de agua.
Septiembre 2010 (Fase Especнfica)
14 − Considerando las sustancias: Br2 , SiO2 , Fe , HF y NaBr , justifique en funciуn de sus enlaces:
a) si son o no solubles en agua;
b) si conducen la corriente elйctrica a temperatura ambiente.
Junio 1999
15 − Para las siguientes especies: Br2 , NaCl , H2O y Fe:
a) Razone el tipo de enlace presente en cada caso.
b) Indique el tipo de interacciуn que debe romperse al fundir cada compuesto.
c) їCuбl tendrб un menor punto de fusiуn?.
d) Razone quй compuesto(s) conducirб(n) la corriente en estado sуlido, cuбl(es) lo harб(n) en estado fundido y cuбl(es) no conducirб(n) la corriente elйctrica en ningъn caso.
Septiembre 2006
16 − Dados los siguientes compuestos: NaH , CH4 , H2O , CaH2 y HF, conteste razonadamente:
a) їCuбles tienen enlace iуnico y cuбles enlace covalente?.
b) їCuбles de las molйculas covalentes son polares y cuбles no polares?.
c) їCuбles presentan enlace de hidrуgeno?.
d) Atendiendo ъnicamente a la diferencia de electronegatividad, їcuбl presenta la mayor acidez?.
Modelo 2007
Pбgina 5
Ejercicios de acceso a la Universidad − Cuestiones de Enlace quнmico
17 − Teniendo en cuenta la estructura y el tipo de enlace, justifique:
a) El cloruro de sodio tiene un punto de fusiуn mayor que el bromuro de sodio.
b) El carbono (diamante) es un sуlido muy duro.
c) El nitrуgeno molecular presenta una gran estabilidad quнmica.
d) El amoniaco es una sustancia polar.
Modelo 2002
18 − A las siguientes especies: X−, Y y Z+, les corresponden los nъmeros atуmicos: 17, 18 y 19, respectivamente.
a) Escriba la configuraciуn electrуnica de cada una de ellas.
b) Ordene, razonadamente, de menor a mayor, las diferentes especies segъn su tamaсo y su energнa de ionizaciуn.
c) їQuй especies son X− e Y?.
d) їQuй tipo de enlace presenta ZX?. Describa brevemente las caracterнsticas de este enlace.
Septiembre 2008
19 − a) Diseсe un ciclo de Born-Haber para el MgCl2.
b) Defina el menos cuatro de los siguientes conceptos:
- Energнa de ionizaciуn.
- Energнa de disociaciуn.
- Afinidad electrуnica.
- Energнa reticular.
- Calor de formaciуn.
- Calor de sublimaciуn.
Septiembre 1996
20 − A partir del esquema del ciclo de Born-Haber para el fluoruro de sodio:
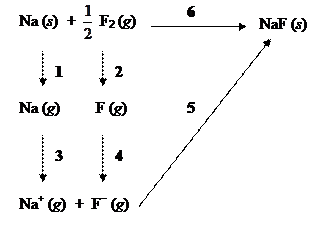 a) Nombre las energнas implicadas en los procesos 1, 2 y 3.
a) Nombre las energнas implicadas en los procesos 1, 2 y 3.
b) Nombre las energнas implicadas en los procesos 4, 5 y 6.
c) Justifique si son positivas o negativas las energнas implicadas en los procesos 1, 2, 3, 4 y 5.
d) En funciуn del tamaсo de los iones justifique si la energнa reticular del fluoruro de sodio serб mayor o menor, en valor absoluto, que la del cloruro de sodio. Justifique la respuesta.
Septiembre 2005
Pбgina 6
Ejercicios de acceso a la Universidad − Cuestiones de Enlace quнmico
21 − Sabiendo que: NaCl , NaBr y NaI adoptan en estado sуlido la estructura tipo NaCl, explique razonadamente:
a) Si la constante de Madelung influye en que los valores de energнa reticular de estos tres compuestos sean diferentes.
b) Si la variaciуn de la energнa reticular depende de la distancia de equilibrio entre los iones en la red cristalina.
c) їLa energнa reticular del MgCl2 serб mayor, menor o igual que la del NaCl?.
Datos: Energнas reticulares: NaCl = 769 kJ∙mol−1
NaBr = 736 kJ∙mol−1
NaI = 688 kJ∙mol−1 .
Modelo 2001
22 − Sabiendo que el boro es el primer elemento del grupo 13 del Sistema Periуdico, conteste razonadamente si las siguientes afirmaciones son verdaderas o falsas:
a) La energнa de ionizaciуn es la energнa que desprende un бtomo, en estado gaseoso, cuando se convierte en un iуn positivo.
b) Las energнa de ionizaciуn del boro es superior a la del litio (Z = 3).
c) La configuraciуn electrуnica del boro le permite establecer tres enlaces covalentes.
d) El бtomo de boro en el BH3 tiene un par de electrones de valencia.
Junio 2006
23 − Dadas las siguientes sustancias: CS2 (lineal), HCN (lineal), NH3 (piramidal) y H2O (angular):
a) Escriba sus estructuras de Lewis.
b) Justifique su polaridad.
Junio 2000
24 − Considere las siguientes molйculas: H2O , HF , H2 , CH4 y NH3 .
Conteste justificadamente a cada una de las siguientes cuestiones:
a) їCuбl o cuбles son polares?.
b) їCuбl presenta el enlace con mayor contribuciуn iуnica?.
c) їCuбl presenta el enlace con mayor contribuciуn covalente?.
d) їCuбl o cuбles pueden presentar enlace de hidrуgeno?.
Septiembre 2004
25 − Dadas las molйculas: H2O , CH4 , BF3 y HCl:
a) Escriba sus estructuras de Lewis.
b) Indique razonadamente cuбles presentan enlaces de hidrуgeno.
c) Justifique cuбles son molйculas polares.
d) Justifique cuбl de las molйculas: H2O , CH4 y HCl presenta mayor carбcter covalente en el enlace y cuбl menor.
Datos: Electronegatividades de Pauling: O = 3,5 , H = 2,1 , C = 2,5 , Cl = 3,0 .
Modelo 2003
Pбgina 7
Ejercicios de acceso a la Universidad − Cuestiones de Enlace quнmico
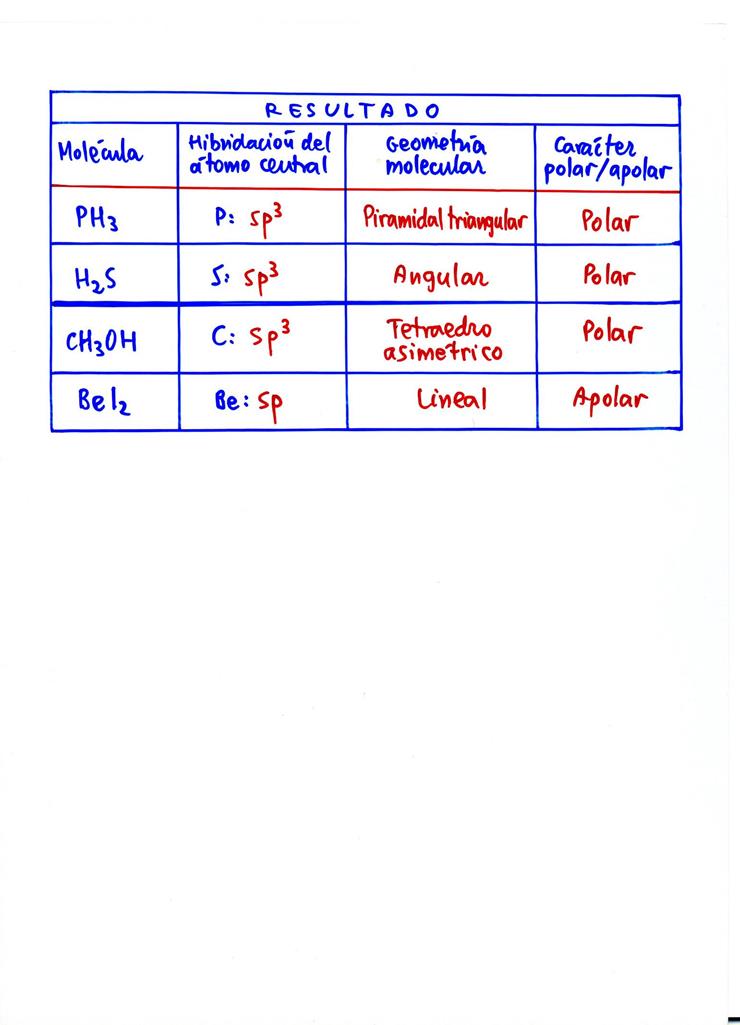
26 − Dadas las siguientes molйculas: PH3 , H2S , CH3OH y BeI2:
a) Escriba sus estructuras de Lewis.
b) Razone si forman o no enlaces de hidrуgeno.
c) Deduzca su geometrнa aplicando la teorнa de hibridaciуn.
d) Explique si estas molйculas son polares o apolares.
Septiembre 2007
27 − Responda a las siguientes cuestiones referidas al CCl4, razonando las respuestas:
a) Escriba su estructura de Lewis.
b) їQuй geometrнa cabe esperar para sus molйculas?.
c) їPor quй la molйcula es apolar, a pesar de que los enlaces C−Cl son polares?.
d) їPor quй, a temperatura ordinaria, el CCl4 es lнquido y, en cambio, el CI4 es sуlido?.
Septiembre 2002
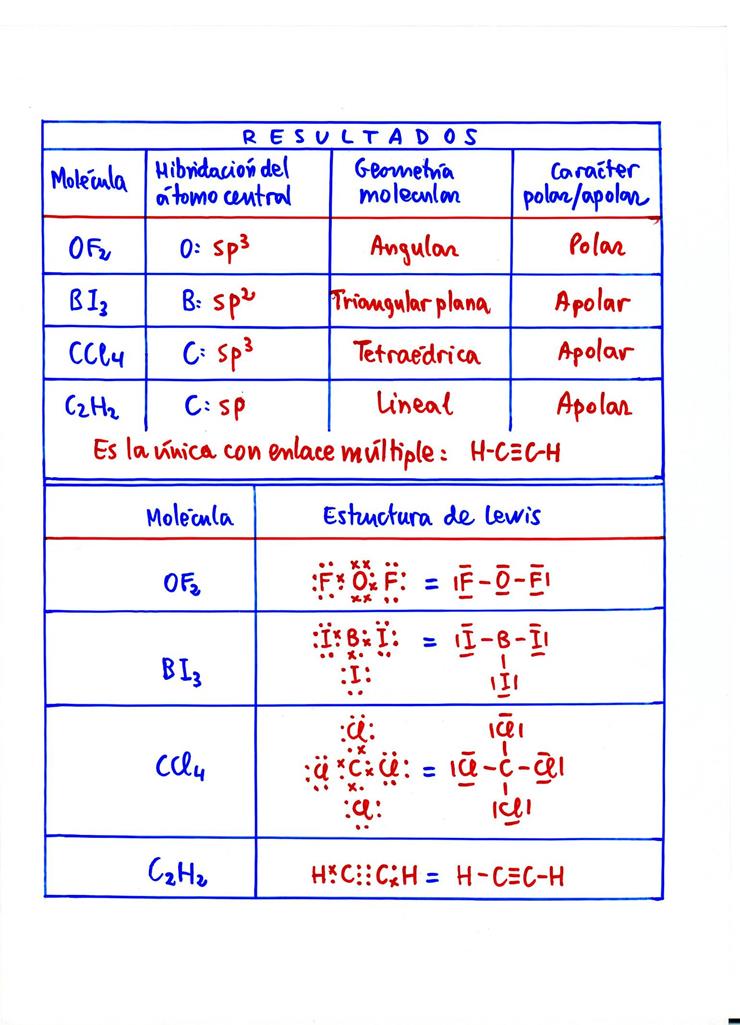
28 − Considere las molйculas: OF2 , BI3 , CCl4 y C2H2 .
a) Escriba sus representaciones de Lewis.
b) Indique razonadamente sus geometrнas moleculares utilizando la teorнa de hibridaciуn de orbitales o bien la teorнa de la repulsiуn de pares electrуnicos.
c) Justifique cuбles son molйculas polares.
d) їQuй molйculas presentan enlaces mъltiples?.
Modelo 2004
29 − Considere las molйculas de amoniaco y sulfuro de hidrуgeno.
a) Escriba sus estructuras de Lewis.
b) Justifique por quй el бngulo HNH es mayor que el бngulo HSH.
c) Justifique cuбl o cuбles son polares.
d) Justifique cuбl de las dos molйculas puede formar enlaces de hidrуgeno.
Junio 2010 (Materias coincidentes)
30 − Dadas las siguientes molйculas: CH4 , NH3 , H2S y BH3:
a) Justifique sus geometrнas moleculares en funciуn de la hibridaciуn del бtomo central.
b) Razone quй molйculas serбn polares y cuбles apolares.
c) їDe quй tipo serбn las fuerzas intermoleculares en el CH4?.
d) Indique, razonadamente, por quй el NH3 es el compuesto que tiene mayor temperatura de ebulliciуn.
Septiembre 2008
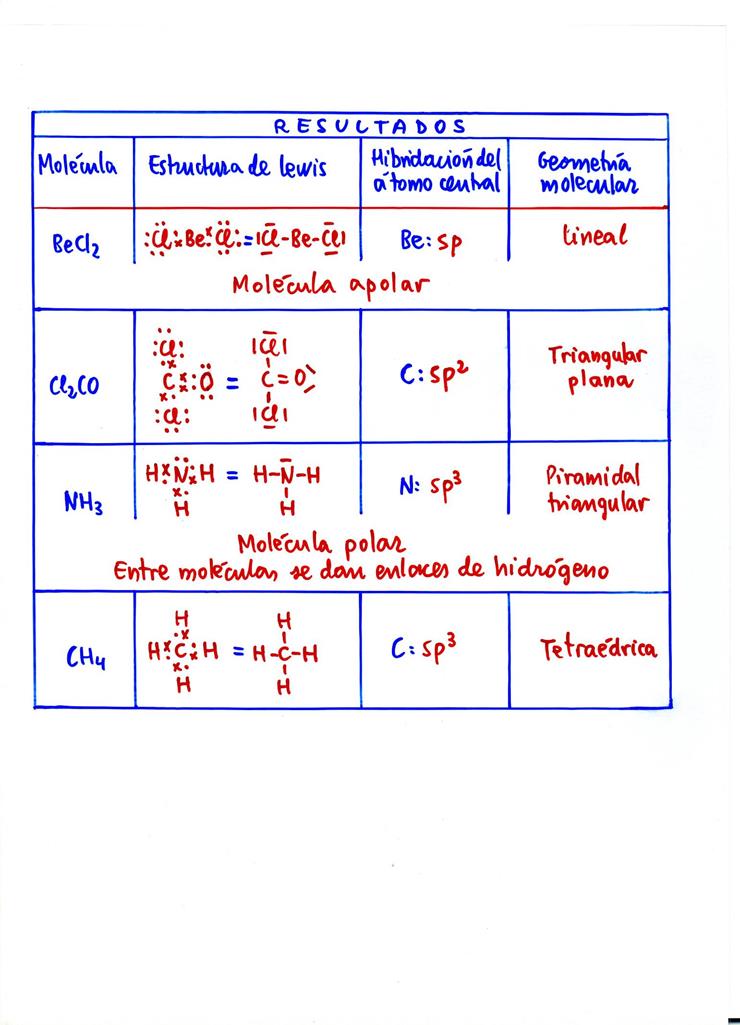
31 − Dadas las siguientes molйculas: BeCl2 , Cl2CO , NH3 y CH4:
a) Escriba sus estructuras de Lewis.
b) Determine sus geometrнas (puede emplear la teorнa de repulsiуn de pares electrуnicos o la de hibridaciуn).
c) Razone si alguna de las molйculas puede formar enlaces de hidrуgeno.
d) Justifique si las molйculas BeCl2 y NH3 son polares o no polares.
Datos: Nъmeros atуmicos (Z): H = 1 , Be = 4 , C = 6 , N = 7 , O = 8 , Cl = 17 .
Junio 2005
Pбgina 8
Ejercicios de acceso a la Universidad − Cuestiones y Preguntas de Enlace quнmico
32 − Dadas las siguientes sustancias: CO2 , CF4 , H2CO y HF:
a) Escriba las estructuras de Lewis de sus molйculas.
b) Explique sus geometrнas por la Teorнa de Repulsiуn de Pares de Electrones de Valencia o por la Teorнa de Hibridaciуn.
c) Justifique cuбles de estas molйculas tienen momento dipolar distinto de cero.
d) Justifique cuбles de estas sustancias presentan enlace de hidrуgeno.
Modelo 2010
33 − Considerando las molйculas: H2CO (metanal) y Br2O (monуxido de dibromo):
a) Represente sus estructuras de Lewis.
b) Justifique su geometrнa molecular.
c) Razone si cada una de estas molйculas tiene o no momento dipolar.
Datos: Nъmeros atуmicos: H (Z = 1), C (Z = 6), O (Z = 8), Br (Z = 35).
Junio 2010 (Fase Especнfica)
34 − Dados los siguientes compuestos: H2S , BCl3 y N2:
a) Escriba sus estructuras de Lewis.
b) Deduzca la geometrнa de cada molйcula por el mйtodo RPECV o a partir de la hibridaciуn.
c) Deduzca cuбles de las molйculas son polares y cuбles no polares.
d) Indique razonadamente la especie que tendrб un menor punto de fusiуn.
Modelo 2008
Pregunta
35 − Considere las molйculas de HCN, CHCl3 y Cl2O.
a) Escriba sus estructuras de Lewis.
b) Justifique cuбles son sus бngulos de enlace aproximados.
c) Justifique cuбl o cuбles son polares.
d) Justifique si alguna de ellas puede formar enlaces de hidrуgeno.
Junio 2011
Pбgina 9
EJERCICIOS RESUELTOS
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Pбgina 11
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Pбgina 12
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1998 − Cuestiуn 1
Pбgina 13
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2009 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2009 − Cuestiуn 1
Pбgina 14
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2009 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2009 − Cuestiуn 1
Pбgina 15
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Pбgina 16
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Pбgina 17
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Pбgina 18
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase General) − Opciуn A − Cuestiуn 1
Pбgina 19
 Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Pбgina 20
 Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Pбgina 21
 Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2005 − Cuestiуn 1
Pбgina 22
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Pбgina 23
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Pбgina 24
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1997 − Cuestiуn 1
Pбgina 25
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Pбgina 26
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Pбgina 27
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2003 − Cuestiуn 1
Pбgina 28
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Pбgina 29
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Pбgina 30
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1999 − Cuestiуn 1
Pбgina 31
 Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Pбgina 32
 Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Pбgina 33
 Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Pбgina 34
 Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 1997 − Cuestiуn 2
Pбgina 35
 Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Pбgina 36
 Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Pбgina 37
 Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2004 − Cuestiуn 2
Pбgina 38
 Ejercicios de acceso a la Universidad − Examen de junio de 1998 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 1998 − Cuestiуn 1
Pбgina 39
 Ejercicios de acceso a la Universidad − Examen de junio de 1998 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 1998 − Cuestiуn 1
Pбgina 40
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Pбgina 41
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Pбgina 42
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 1
Pбgina 43
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase Especнfica) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase Especнfica) − Opciуn A − Cuestiуn 1
Pбgina 44
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase Especнfica) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2010 (Fase Especнfica) − Opciуn A − Cuestiуn 1
Pбgina 45
 Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Pбgina 46
 Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Pбgina 47
 Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 1999 − Cuestiуn 1
Pбgina 48
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Pбgina 49
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Pбgina 50
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2006 − Cuestiуn 2
Pбgina 51
 Ejercicios de acceso a la Universidad − Modelo de examen para 2007 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2007 − Cuestiуn 2
Pбgina 52
 Ejercicios de acceso a la Universidad − Modelo de examen para 2007 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2007 − Cuestiуn 2
Pбgina 53
 Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Pбgina 54
 Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Pбgina 55
 Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2002 − Cuestiуn 1
Pбgina 56
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 1
Pбgina 57
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 1
Pбgina 58
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Pбgina 59
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Pбgina 60
 Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 1996 − Cuestiуn 1
Pбgina 61
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Pбgina 62
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Pбgina 63
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Ejercicios de acceso a la Universidad − Examen de septiembre de 2005 − Cuestiуn 5
Pбgina 64
 Ejercicios de acceso a la Universidad − Modelo de examen para 2001 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2001 − Cuestiуn 2
Pбgina 65
 Ejercicios de acceso a la Universidad − Modelo de examen para 2001 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2001 − Cuestiуn 2
Pбgina 66
 Ejercicios de acceso a la Universidad − Examen de junio de 2006 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2006 − Cuestiуn 1
Pбgina 67
 Ejercicios de acceso a la Universidad − Examen de junio de 2006 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2006 − Cuestiуn 1
Pбgina 68
 Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Pбgina 69
 Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Pбgina 70
 Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de junio de 2000 − Cuestiуn 2
Pбgina 71
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Cuestiуn 2
Pбgina 72
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2004 − Cuestiуn 2
Pбgina 73
 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Pбgina 74
 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Pбgina 75
 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Pбgina 76
 Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2003 − Cuestiуn 1
Pбgina 77
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Pбgina 78
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Pбgina 79
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Pбgina 80
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Pбgina 81
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de septiembre de 2007 − Cuestiуn 1
Pбgina 82
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Pбgina 83
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Pбgina 84
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Ejercicios de acceso a la Universidad − Examen de septiembre de 2002 − Cuestiуn 3
Pбgina 85
 Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Pбgina 86
 Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Pбgina 87
 Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Pбgina 88
 Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Pбgina 89
 Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Modelo de examen para 2004 − Cuestiуn 1
Pбgina 90
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Materias coincidentes) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Materias coincidentes) − Opciуn A − Cuestiуn 1
Pбgina 91
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Materias coincidentes) − Opciуn A − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Materias coincidentes) − Opciуn A − Cuestiуn 1
Pбgina 92
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Pбgina 93
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Pбgina 94
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Pбgina 95
 Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Examen de septiembre de 2008 − Cuestiуn 2
Pбgina 96
 Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Pбgina 97
 Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Pбgina 98
 Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Pбgina 99
 Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Pбgina 100
 Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2005 − Cuestiуn 1
Pбgina 101
 Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Pбgina 102
 Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Pбgina 103
 Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Pбgina 104
 Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Pбgina 105
 Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2010 − Opciуn A − Cuestiуn 2
Pбgina 106
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Pбgina 107
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Pбgina 108
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Pбgina 109
 Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Ejercicios de acceso a la Universidad − Examen de junio de 2010 (Fase Especнfica) − Opciуn B − Cuestiуn 1
Pбgina 110
 Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Pбgina 111
 Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Pбgina 112
 Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Pбgina 113
 Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Pбgina 114
 Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Ejercicios de acceso a la Universidad − Modelo de examen para 2008 − Cuestiуn 2
Pбgina 115
 Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Pбgina 116
 Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Pбgina 117
 Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Pбgina 118
 Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Ejercicios de acceso a la Universidad − Examen de junio de 2011 − Opciуn B − Pregunta 1
Pбgina 119
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|