
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
БХ – Ферменты – 5. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов В6, РР и В2 на примере трансаминаз и дегидрогеназ»
БХ – Ферменты – 5
«Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов В6, РР и В2 на примере трансаминаз и дегидрогеназ»
Ферменты бывают однокомпонентными и двухкомпонентными:
- Однокомпонентные ферменты состоят только из аминокислот, то есть это «чистые» белки без каких-либо дополнительных компонентов;
- Двухкомпонентные ферменты состоят не только из аминокислот, помимо белковой части у них есть так называемая «небелковая часть».
Белковая часть двухкомпонентных ферментов называется «апоферментом». Сама по себе они НЕ проявляет каталитическую активность, для того, чтобы она стала «полноценным» ферментом, необходимо её соединение с небелковой частью. Апофермент в комплексе с небелковым компонентом называется «голоферментом», именно в таком виде он способен выполнять свою функцию.
Небелковая часть двухкомпонентных ферментов называется «кофактор». Кофакторы могут иметь как органическую природу, так и неорганическую. В роли неорганических кофакторов ВСЕГДА выступают ионы металлов (железа, меди, кобальта и т.д.).
Органические кофакторы, в свою очередь, также подразделяются на «простетические группы» и «коферменты».
Простетические группы связаны с апоферментами прочно и не могут свободно приходить/уходить из фермента, в ходе его деятельности. Простетические группы высвобождаются из ферментов в основном после РАЗРУШЕНИЯ фермента. Примером простетической группы служит гем.
Коферменты связаны с апоферментами непрочной связью, они могут диссоциировать от апофермента (отсоединяться от него) и после снова возвращаться в его состав. Примером кофермента могут служить NAD+ и NADP+. Некоторые ферменты начинают работать только после того, как к ним присоединится, например, NAD+, тогда указывается «NAD+-зависимый» и т.д. Коферменты логично рассматривать как второй субстрат для фермента.
Электрофильный катализ. Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+. Ионы щёлочно-земельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза - цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
СО + H2O ↔ H2CO3.
Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды:
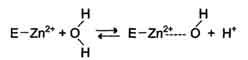 Е - энзим (т.е. фермент)
Е - энзим (т.е. фермент)
Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты.
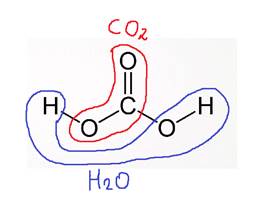
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
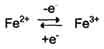
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях - работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С.
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди.
Фермент, содержащий ион Сu2+, не вступает в реакцию с молекулой кислорода. При восстановлении Си2+ до Си+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
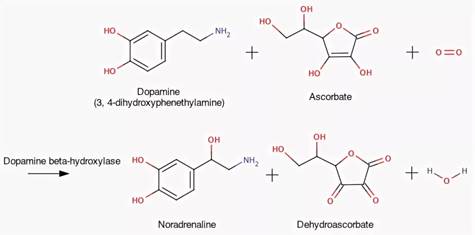
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
-производные витаминов;
-гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
-нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
-убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
-S-аденозилметионин (SAM) - донор метильной группы;
-глутатион, участвующий в окислительно-восстановительных реакциях.
Витамин B6 (пиридоксин) и его производное ПФ (пиридоксальфосфат):
1. Является коферментом фосфорилазы гликогена (50% всего витамина находится в мышцах), участвует в синтезе гема, сфинголипидов.
2. Наиболее известная функция пиридоксиновых коферментов – перенос аминогрупп и карбоксильных групп в реакциях метаболизма аминокислот:
- кофермент аминотрансфераз, переносящих аминогруппы между аминокислотами и кетокислотами;
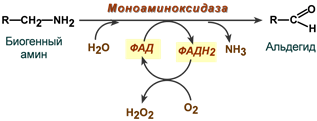
- кофермент декарбоксилаз, участвующих в синтезе биогенных аминов из аминокислот – серотонина, гамма-аминомасляной кислоты (ГАМК), гистамина.
Витамин PP (ниацин) и его производные никотинамидадениндинуклеотид (NAD+) и никотинамидадениндинуклеотидфосфат (NADP+):
1. Метаболизм белков, жиров и углеводов. Так как NAD+ и NADP+ служат коферментами большинства дегидрогеназ, то они участвуют в реакциях:
-при синтезе и окислении карбоновых кислот;
-при синтезе холестерола;
-обмена глутаминовой кислоты и других аминокислот;
-обмена углеводов: пентозофосфатный путь, гликолиз;
-окислительного декарбоксилирования пировиноградной кислоты;
-цикла трикарбоновых кислот.
2. NADH выполняет регулирующую функцию, поскольку является ингибитором некоторых реакций окисления, например, в цикле трикарбоновых кислот.
3. Защита наследственной информации – NAD+ является субстратом поли-АДФ-рибозилирования в процессе сшивки хромосомных разрывов и репарации ДНК.
4. Защита от свободных радикалов – NADPH является необходимым компонентом антиоксидантной системы клетки.
5. NADPH участвует в реакциях:
-ресинтеза тетрагидрофолиевой кислоты (кофермент витамина B9) из дигидрофолиевой после синтеза тимидилмонофосфата;
-восстановления белка тиоредоксина при синтезе дезоксирибонуклеотидов;
-для активации "пищевого" витамина К или восстановления тиоредоксина после реактивации витамина К.
Витамин B2 (рибофлавин) и его производные флавинмононуклеотид (FMN), флавинадениндинуклеотид (FAD):
1. Дегидрогеназы энергетического обмена – пируватдегидрогеназа (окисление пировиноградной кислоты), α-кетоглутаратдегидрогеназа и сукцинатдегидрогеназа (цикл трикарбоновых кислот), ацил-SКоА-дегидрогеназа (окисление жирных кислот), митохондриальная α-глицеролфосфатдегидрогеназа (челночная система).
2. Оксидазы, окисляющие субстраты с участием молекулярного кислорода. Например, прямое окислительное дезаминирование аминокислот или обезвреживание биогенных аминов (гистамин, ГАМК).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|