
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Міністерство освіти та науки, молоді та спорту.
Міністерство освіти та науки, молоді та спорту.
Загальноосвітня середня школа І-ІІІ ступенів «Лідер»
з різними формами навчання.
Ферум: будова атома, поширення в природі
Виконала: учениця 7-а класу
Тихонька У.Т.
Львів-2012
Ферум – металічний елемент побічної підгрупи, VІІІ групи, 4 періоду періодичної системи хімічних елементів.
Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 ·nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Чисте залізо — сріблясто-білий блискучий метал з температурою плавлення 1535 ºС і густиною 7,87 г/см3. Від інших металів залізо відрізняється магнітними властивостями. Залізо є дуже пластичним металом і легко піддається обробці.
Залізо належить до металів середньої активності. Хімічно чисте залізо стійке до корозії. Однак незначні частки домішок позбавляють його цієї властивості.
Залізо згоряє в кисні. Продукт цієї реакції – залізна ожарина:
3Fe + 2O2 = Fe3O4.
Залізо реагує і з іншими неметалами — галогенами, сіркою, вуглецем. При взаємодії з сильними окисниками, наприклад, хлором утворюються сполуки Феруму з ступенем окиснення +3:
2Fe + 3Сl2 = 2FeCl3,
а при взаємодії з менш активними окисниками утворюються сполуки зі ступенем окиснення Феруму +2:
Fe + S = FeS.
За високої температури залізо реагує з водяною парою. У результаті реакції утворюються залізна ожарина і водень:
3Fe + 4H2O 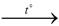 Fe3O4 + 4H2↑.
Fe3O4 + 4H2↑.
Залізо реагує з розчинами кислот з утворенням солей і виділенням газуватого водню:
Fe + H2SO4 = FeSO4 +H2↑.
Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється щільна оксидна плівка; тому ці концентровані кислоти можна зберігати і транспортувати у сталевих цистернах.
Залізо заміщує менш активні метали при взаємодії з розчинами їх солей:
Fe + CuSO4 = FeSO4 +Cu.
На вологому повітрі залізо зазнає корозії. Її продуктом є іржа. Унаслідок своєї пористості іржа не перешкоджає доступу кисню й вологи до металу, що призводить до подальшого руйнування металу.
Залізо — найважливіший метал сучасної техніки. У чистому вигляді залізо майже не використовується, але приблизно 90 % металів, що використовуються людством — це сплави на основі заліза. Заліза виплавляється у світі дуже багато, приблизно в 50 разів більше, ніж алюмінію, не говорячи вже про інші метали. На основі заліза створюють сплави, які здатні витримувати вплив високих і низьких температур, вакууму і високих тисків, агресивних середовищ тощо. Сплави заліза широко застосовують як конструкційні та художні матеріали.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|