
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опорный конспект «АЛКЕНЫ». Химические свойства
Опорный конспект «АЛКЕНЫ»
Алкены– непредельные углеводороды, в молекулах которых содержится одна двойная связь между атомами углерода.
Общая формула - СnH2n
Тип гибридизации атомов С при двойной связи - sp2,
Валентный угол 1200 (гибридные облака атомов углерода при двойной связи направлены к вершинам правильного треугольника),
Длина связи С=С равна 0,134нм, связь С=С образована σ- и π-связями
Виды изомерии – структурная изомерия - углеродного скелета (С≥4),
- положения кратной связи(С≥4),
- межклассовая (изомерны циклоалканам)
- пространственная изомерия - (цис-транс-изомерия)
Химические свойства
| Взаимодействие | Уравнение реакции | Примечание |
| 1. р. окисления | 1. р. горения (полного окисления):
Общее уравнение СnН2n +  О2= nСО2 +nН2О+Q
частичное окисление этилена в присутствии катализатора:
2н2с=Сн2 + о2 О2= nСО2 +nН2О+Q
частичное окисление этилена в присутствии катализатора:
2н2с=Сн2 + о2 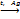 2Н2С—СН2
О оксид этилена
2. Неполное окисление раствором КМnO4
А) в щелочной или нейтральной среде - обесцвечивание водного раствора КМnO4 (р. Вагнера):
3С2Н4 + 2КМnО4 + 4Н2О → 3H2C ─CH2 + 2MnО2 + 2KOH
ОН ОН
этандиол-1,2 (этиленгликоль)
Б) в кислой среде (H2SO4 или HNO3) –в жестких условиях (кипящий р-р КМnО4) происходит разрыв π- и σ-связей с бразованием карбоновых кислот или СО2:
СНз ─СН═СН─СНз + 4[0] 2Н2С—СН2
О оксид этилена
2. Неполное окисление раствором КМnO4
А) в щелочной или нейтральной среде - обесцвечивание водного раствора КМnO4 (р. Вагнера):
3С2Н4 + 2КМnО4 + 4Н2О → 3H2C ─CH2 + 2MnО2 + 2KOH
ОН ОН
этандиол-1,2 (этиленгликоль)
Б) в кислой среде (H2SO4 или HNO3) –в жестких условиях (кипящий р-р КМnО4) происходит разрыв π- и σ-связей с бразованием карбоновых кислот или СО2:
СНз ─СН═СН─СНз + 4[0] 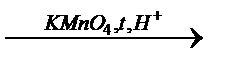 2CH3-COOH
5СН3─СН═СН─СН3+8KMnO4+12H2SO4 2CH3-COOH
5СН3─СН═СН─СН3+8KMnO4+12H2SO4 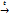 10CH3-COOH+4K2SO4+8MnSO4 +12H2O
СН3-CH2-СН═СН2+2KMnO4+3H2SO4 10CH3-COOH+4K2SO4+8MnSO4 +12H2O
СН3-CH2-СН═СН2+2KMnO4+3H2SO4 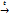 CH3-CH2-COOH+CO2+K2SO4+2MnSO4+4H2O CH3-CH2-COOH+CO2+K2SO4+2MnSO4+4H2O
| Качественная реакция -обесцвечивание раствора перманганата калия |
| 2. р. присоединения | 1. Гидратация (+H2O) (Правило В.В.Марковникова):
Н3С-СН=СН2 + Н-ОН 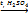 Н3С–СН–СН3
пропен OH пропанол-2
2. Гидрогалогенирование (+HCl, +HBr, +HI) (Правило В.В.Марковникова):
Н3С-СН=СН2 + Н-Вг →Н3С–СН–СН3
пропен Вr 2-бромпропан
Н3С-СН=СН2 + Н-Вг Н3С–СН–СН3
пропен OH пропанол-2
2. Гидрогалогенирование (+HCl, +HBr, +HI) (Правило В.В.Марковникова):
Н3С-СН=СН2 + Н-Вг →Н3С–СН–СН3
пропен Вr 2-бромпропан
Н3С-СН=СН2 + Н-Вг 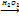 Н3С-СН2-СН2Вr (пероксидный эффект)
пропен 1-бромпропан
3. Гидрирование:
сн2=сн2 + н2 Н3С-СН2-СН2Вr (пероксидный эффект)
пропен 1-бромпропан
3. Гидрирование:
сн2=сн2 + н2 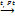 сн3-сн3
этен этан
4. Галогенирование (протекает при обычных условиях):
Н2С=СН2 + Вг2 → Н2С─СН2
Вг Вг 1,2-дибромэтан сн3-сн3
этен этан
4. Галогенирование (протекает при обычных условиях):
Н2С=СН2 + Вг2 → Н2С─СН2
Вг Вг 1,2-дибромэтан
| Правило В. В. Марковникова: в реакциях гидратации и гидрогалогенирования водород присоединяется к более гидрированному, а гидроксогруппа или галоген — к менее гидрированному атому углерода при двойной связи. Пероксидный эффект — гидрогалогенирование в присутствии пероксидов (Н2О2) не подчиняется правилу Марковникова Качественная реакция - обесцвечивание бромной воды |
| 5. р. полимеризации | nH2C═CH2 → (-CH2-CH2-)n этилен полиэтилен |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|