
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опорный конспект №1 «АЛКАНЫ». Химические свойства
Стр 1 из 2Следующая ⇒
Опорный конспект №1 «АЛКАНЫ»
Алканы (парафины) – предельные углеводороды, в молекулах которых каждый атом углерода связан с максимальным количеством других атомов.
Общая формула - СnH2n+2
Тип гибридизации всех атомов С - sp3,
Валентный угол 109028' (гибридные облака направлены к вершинам тетраэдра),
Длина связи С-С равна 0,154нм.
Виды изомерии – изомерия углеродного скелета.
Химические свойства
| Взаимодействие | Уравнение реакции | Примечание |
| 1. р. замещения (разрыв связи С-Н) | 1. Галогенирование(+Cl2 , +Br2)
(с йодом реакция не идёт ни при каких условиях)
 Н3С–СН2–СН3+Br2 Н3С–СН2–СН3+Br2  Н3С–СН–СН3 +НBr
Br
(замещение протекает по свободно-радикальному механизму)
2. Нитрование (+HNO3) (р Коновалова) Н3С–СН–СН3 +НBr
Br
(замещение протекает по свободно-радикальному механизму)
2. Нитрование (+HNO3) (р Коновалова)
 NO2 NO2
  Н3С–СН–СН3+ HO-NO2 Н3С–СН–СН3+ HO-NO2 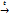 Н3С–СН–СН3 +Н2O
CH3 CH3 Н3С–СН–СН3 +Н2O
CH3 CH3
| в первую очередь замещаются атомы водорода у третичного, затем у вторичного, в последнюю очередь у – первичного атома углерода |
| 2. р. окисление | 1. Горение (полное окисление):
Общее уравнение СnН2n+2 + 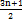 О2= nС02 +(n+1)Н20 +Q
II. Каталитическое окисление метана кислородом воздуха. Взависимости от условий (различные катализаторы и температуры окисления) образуется или спирт, или альдегид, или кислота: О2= nС02 +(n+1)Н20 +Q
II. Каталитическое окисление метана кислородом воздуха. Взависимости от условий (различные катализаторы и температуры окисления) образуется или спирт, или альдегид, или кислота:
  t, кат СН3ОН
метанол t, кат СН3ОН
метанол
 СН4 + O2 t, кат HCOH + Н2О
метаналь СН4 + O2 t, кат HCOH + Н2О
метаналь
 t, кат HCOОH + Н2О
метановая кислота
Гомологи метана окисляются при высоких температурах с разрывом углеродной цепи (С—С) и образованием преимущественно кислот:
2H3C-CH2-CH2-CH3 + 5О2 t, кат HCOОH + Н2О
метановая кислота
Гомологи метана окисляются при высоких температурах с разрывом углеродной цепи (С—С) и образованием преимущественно кислот:
2H3C-CH2-CH2-CH3 + 5О2 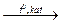 4СН3СООН + 2Н2О
бутан этановая кислота 4СН3СООН + 2Н2О
бутан этановая кислота
| |
| 3. Термическое разложение | 1. Крекинг
Термический крекинг проводят при 450—700 °С;
каталитический — при более низкой температуре (400— 500 °С) в присутствии катализаторов (алюмосиликаты):
Н3С-СН2-|-СН2-СН3 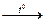 СН3-СН3 + СН2=СН2
2. Дегидрирование
2CH4 СН3-СН3 + СН2=СН2
2. Дегидрирование
2CH4 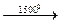 С2Н2 + ЗН2
СnН2n+2 С2Н2 + ЗН2
СnН2n+2 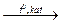 СnН2n + Н2
3. Пиролиз
CH4 СnН2n + Н2
3. Пиролиз
CH4 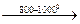 С + 2Н2 С + 2Н2
| |
| 4. Изомеризация превращение алкана нормального строения в его разветвленный изомер |  H3С-СН2-СН2-СН3 H3С-СН2-СН2-СН3 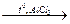 Н3С-СН-СН3
CH3 Н3С-СН-СН3
CH3
| |
| 5. Дегидроциклизация, или ароматизация |  H3С-СН2-СН2-СН2-СН2-СН3 H3С-СН2-СН2-СН2-СН2-СН3 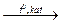 гексан бензол
гексан бензол
| характерна для алканов с шестью и более углеродными атомами |
| 6. Конверсия метана | CH4 +2Н20 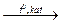 СО + 3 Н2
CH4 +СО2 СО + 3 Н2
CH4 +СО2 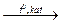 2СО + 2 Н2
Алканы не обесцвечивают бромную воду и раствор перманганата калия при обычных условиях 2СО + 2 Н2
Алканы не обесцвечивают бромную воду и раствор перманганата калия при обычных условиях
| для получения синтез-газа СО + Н2 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|