
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Радиальная мобильность рецепторов нейромедиаторов.



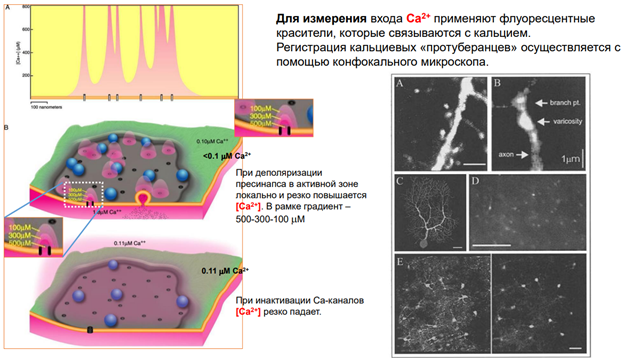
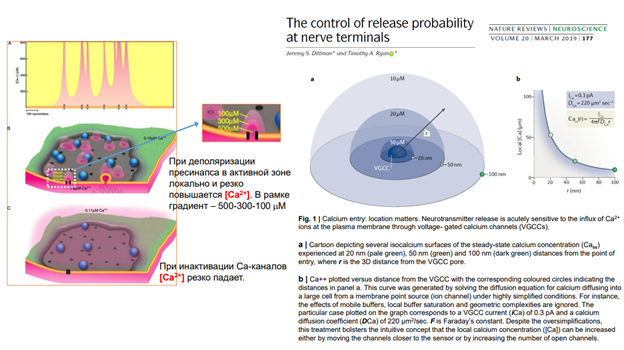
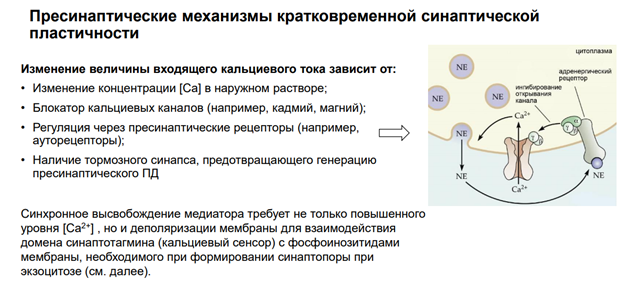
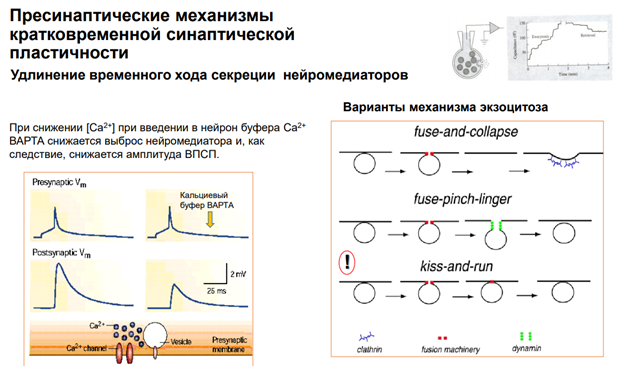



Эффекты прямой синаптической передачи (мембран рецептор реагирует, управляет проводимостью катионообмен)
ГАМК у беспв в некоторых синапсах является возбуждающим, может вызывать деполяризации мембраны
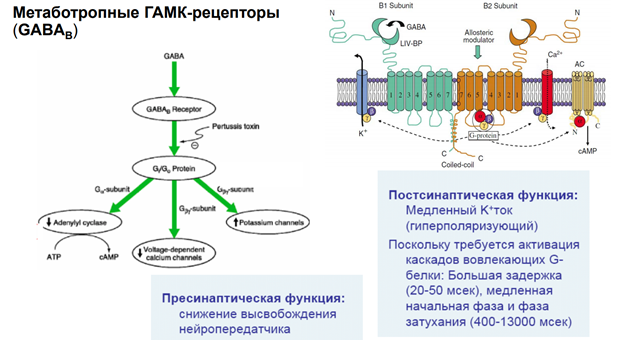
Метаботропн рецепторы, активировать каскады.
Газы - не типичные нейромедиаторы. Их мишени - не рецепторы, а др вещества (... Цеклаза).
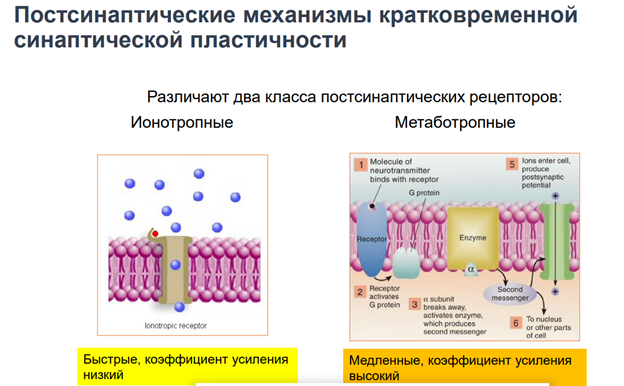
Метаботропн рецепторы в отл от... - каскады. Каскад - некая последовательность превращений.
Иногда для активации ионотропн рецептора требуется 1-3 молекулы
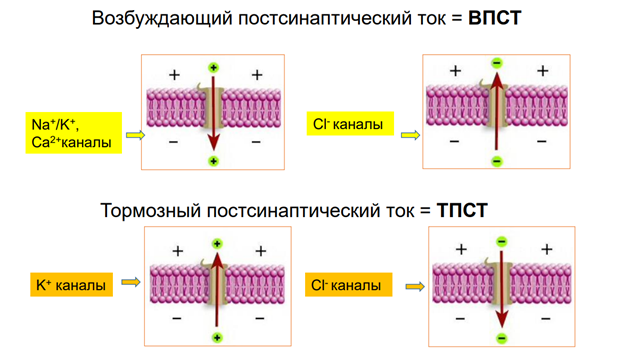
Пст -пост синапт ток
Выход калия - торможение, прекращение входа кальция (кот активирует экзоцитоз)
G- белки. Большая задержка всех эффектов
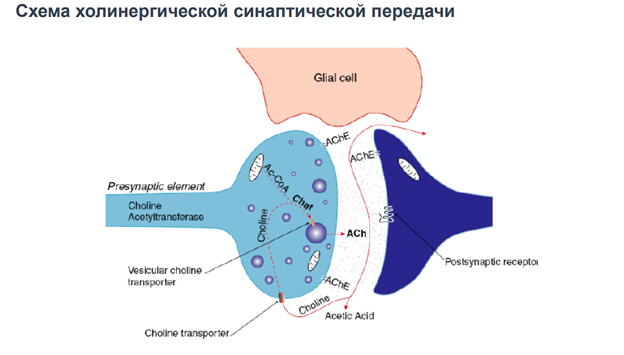
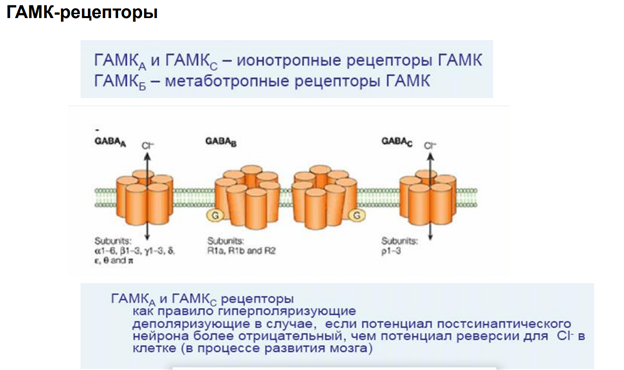
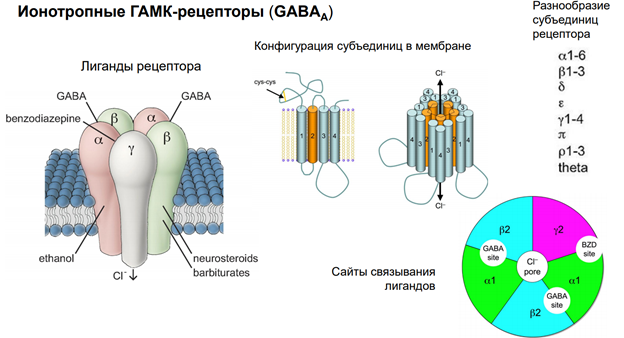
Гамк рецептор. В его состав 5 субъединиц. Каждая представлена 4 транс мембранными участками. Много субъединиц. Варианты его разнообразны поэтому. Есть места связывария для барбитуратов (бензодезепиновая субъединица, выполняет тебя же эффекты что и гамк, наличие бензодиазепинов усиливает эффект, выполняет ф-ю ко медиаторов). Блокатор - микро токсин (прекращает проводимость через холодный канал).
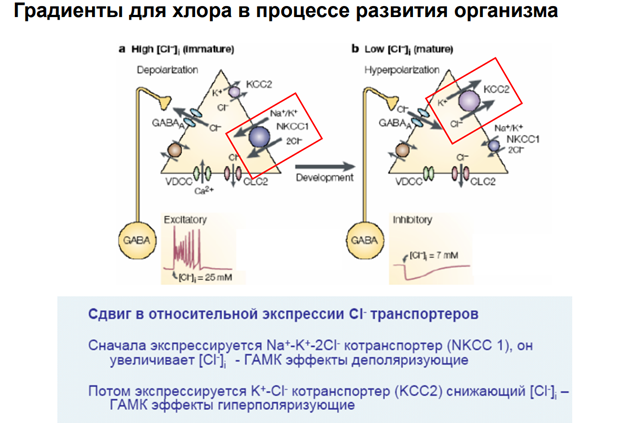
В незрелых нейронах эти клетках работает с-мах переноса хлора. Натрий-калиевый транспорте. Обеспечивает закачку хлора. Натрий вх, калий вых, и потенциал покоя повышается. И когда мы действуем на хлора канал гамком, хлора начинает выходить. Получаем возбуждающий эффект
В зрелом доминирует калий хоолны транспортёр. Выводит хлора за счёт калия. Гипер поляризация.
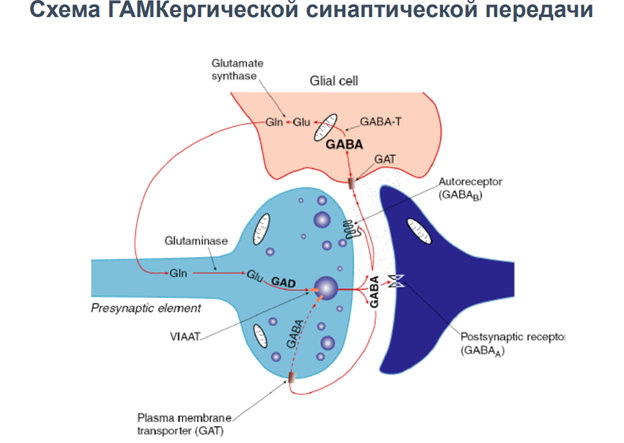
На всех синапсах есть рецепторы для связывания ацх. Эти метаботропн ведь рецепторы, который активирся гамком. Ретроградная регуляция выделения нейромедиатора. Обеспечивает снижение выделения самой себя. Блокируется кальциевый канал, который зап экзоцитоз. Вероятность уменьшается выхода кальция.
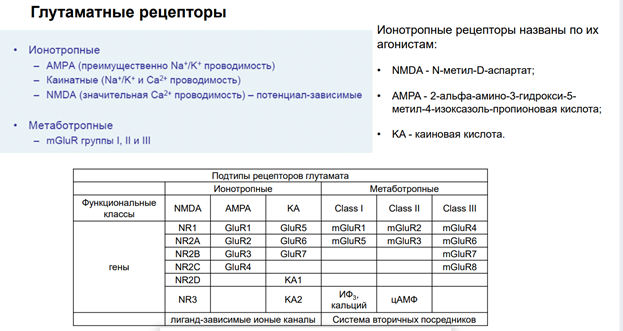
Глутаматные рецепторы.
Ионотропн рецепторы. Три группы : NMD, Ampa и Каиновые. Ампа и Каиновые похожи.
Ампа преимущественно обладают на натрий калевой проводимостью. Нмда много кальция проводят.
Метабооропные тоже делят на три группы.

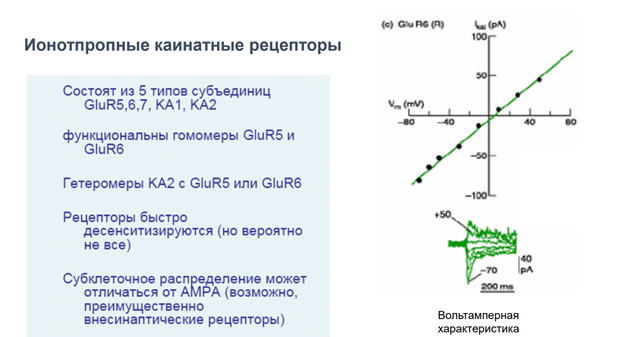



Одни из Глютаматных рецепторов метаботропных обеспечивает пластические перестройки на клетках Пуркинье мозжечка, обеспечивая синаптическую дипрессию.
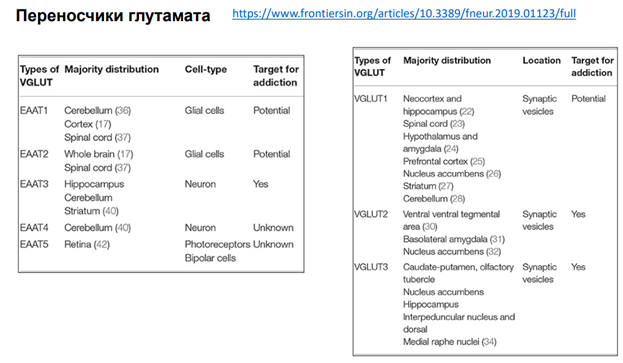
https://www.frontiersin.org/articles/10.3389/fneur.2019.01123/full
Кроме ионных процессов, активации рецепторов очень важны другие участники синаптич передачи – переносчики: глютамата, нейромедиаторов. Они относятся к ионным обменникам, ко вторичной системе переноса (первичные процессы с участием АТФ происходят, т.к для работы этих насосов (попм) требуется молекула АТФ и первичн системы мембранного транспорта – обеспечивают ионный градиент, необх-ый для функционирования клеток; а вот уже ионные градиенты используются другими переносчиками, которые используют энергию от разности концентраций).
Переносчиков огромное кол-во. В левой таблице переносчики Глутамата(через мембрану), а в правой – везикулярные переносчики(перетаскивают Глютамат в синаптические везикулы).
Переносчики Глутамата через мембарну (5 шт в таблице) локализованы: 1 и 2 тип в глиальных клетках локализованы, 3 и 4 – в нейронах, 5 – в фоторецепторах сетчатки.
Везикулярные переносчики – были обнаружены в синаптических везикулах.
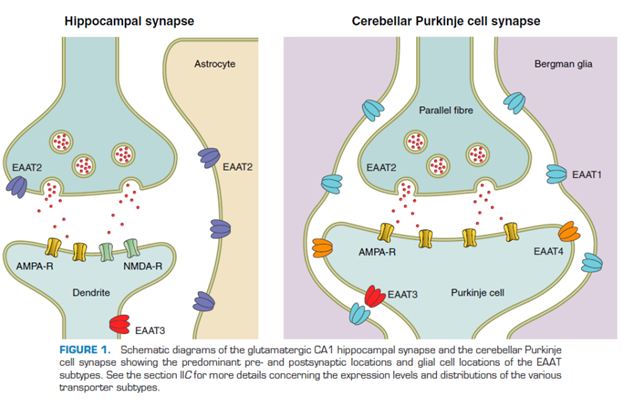
Тут показано, где локализованы эти переносчики. А астроцитах, … (см слайд выше).
Астроциты извлекают из синаптич щели глютомат. Вовлекают в его в цикл, чтобы потом вернуть обратно.
В клетке Пуркинье тоже хорошо представлены (картинка слева). Бергманская глия – в принципе, выполняют такую же функцию, как и астроциты, просто у них другая локализация и есть некоторые особенности.
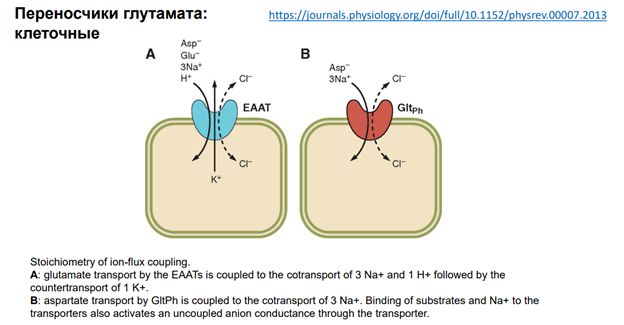
https://journals.physiology.org/doi/full/10.1152/physrev.00007.2013
Переносчики работают за счет градиента Калия и иногда за счет градиента Хлора, а также тут может участвовать Натрий, как главная движущая сила.
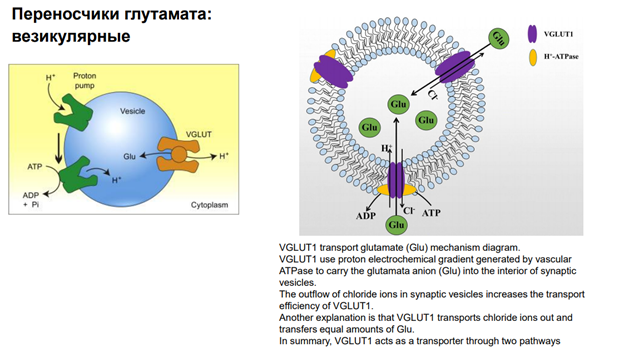
Смотрим левую картинку: Перед тем, как переносить Глютамат, надо создать протонный градиент, поскольку везикулярные переносчики используют градиент протонов! (а не градиент каких-то ионов) Чтобы создать это градиент необходима система первичного транспорта. И вот есть H-ATP-аза (Эйч-АТээФаза), которая закачивает в везикулы протоны. И благодаря выходу протонов (они выходят по своим концентрационным градиентам), глютамат попадает в везикулу.
На правой картинке аналогичная схема.
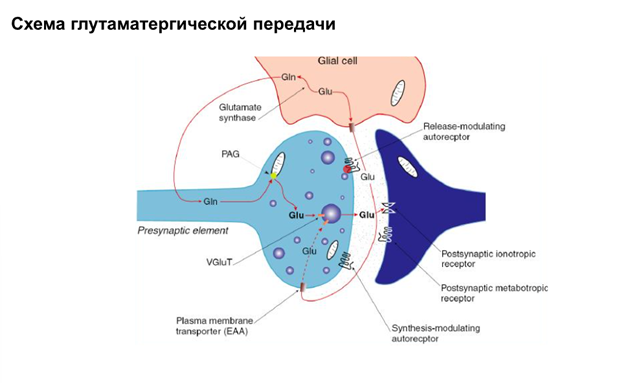
Глтаматный синапс.
Глутамат переносчиком возвращается в глиальную клетку. Он может вернуться также и в саму пресинаптическую клетку. Иногда он может попасть и в постсинаптическую клетку.
В глиальной клетке (астроците) происх некоторые превращения глутамата – он превращ-ся в глутамин , а глутамин уже переносчиками (тут 2 переносчика: через астроциты и через нейронный транспортер). И в нейроне уже из глутамина глутамат получается.
На постсинаптической мембране есть метаботропные рецепторы глутамата. На пресинаптической тоже они есть. Функция их (такая же, как для ГАМК-рецепторов и некотор других): активируют специальные G-белки (которые сопряжены с этими глютаматными рецепторами), и субъединица бетта-гамма – чать G-белка полного – обеспечивает активацию Калиевой проводимости и блокирует Кальциевые каналы. Т.о. в этом синапсе происходит ретроградная регуляция выделения глютамата из синаптической щели

Какие факторы обеспечивают постсинап пластичность.
- хеморецепторный
- мобильность медиаторных рец-ов
- радиальная (интернализация – когда процесс – когда рецептор рецептор захватывается из мембран. Рецеклирование – рецепторы возвращаются в мембрану).
- латеральная – диффузия рецепторов, когда они за счет транспорт систем расходятся в разные стороны

За счет чего происходит повышение потенциации чувствительности постсинаптических рецепторов нейромедиаторов.
е 
Есть несколько процессов, которые характеризуют увеличение чувствительности.
Один из процессов - Фасилитация. Увеличение амплитуды происходит во время ритмического раздражения, когда стимулирующие афферентные входы получают получают стимулы с относительно высокой частотой. Оно может длиться дольше ритмического раздражения, т.е. короткой пачкой постимулировали, а фасилитация еще наблюдается. На картике справа видим ответ на 1ый стимул (первая красная стрелка), на 2 уже ответ возрастает.
Что лежит в основе фасилитации? При высокой частотной или интенсивной стимуляции афферентных путей происходит выделившегося медиатора (увеличение квантов медиатора в синаптической щели). Поскольку во время деполяризации активируются потенциалзависимые Кальциевые каналы, Кальция становится много в пресинаптическом окончании (его еще называют остаточным, т.к. если прекратить стимуляцию, мембрана пресинаптическая уже достаточно активирована, и больше активировать ее не надо уже, но кальций там остается, и это повышает вероятность экзоцитоза; потом-то транспортные системы этот лишний кальций вытащат). *Кальций в 4-ой степени – т.е. если даже немногожко добавить кальция, это обеспечит фасилитацию=облегчение дальнейших эффектов.
Усиление. Много в пресинаптической щели нейромедиатора, который обеспечивает длительную активацию постсинаптического нейрона. (остальное он тупо по слайду прочитал)
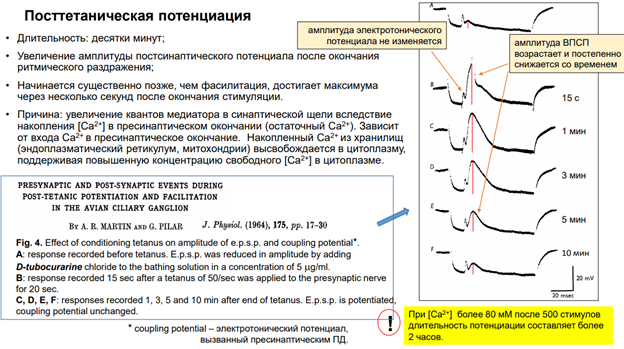
Эти процессы давно известны. Это статья статья 1965 года. Эксперимент был выполнен на цилиарном ганглии цыплёнка.
Есть входы в цилиарный ганглий, которые мы стимулируем одиночным импульсом и получаем ВПСП (волна вверх на рисунке справа). А – в покое – ВПСП маленький. Добавили тут Д-тубокурарин, чтобы он немного снизил активность, поскольку он блокирует проводимость (иначе были бы очень большие эффекты)
Затем мы потенциируем мембрану, т.е прикладываем высоко частотную стимуляцию (50 раздражений в секунду в течение 20 сек). Т.е. на вход цилиарного ганглия мы подаем 50*20=1000 стимулов. И после этого спустя 15 сек даем единичный стимул.
Фрагменты Б-Ф – после тетануса. Получаем увеличенный потенциал. *Электротонический потенциал – потенциал в пресинаптическом волокне; он электротонически проникает в постсинаптический нейрон; и его амплитуда одна и та же, не меняется со временем (это означает, что активация входа одна и та же, активируем в одной и той же степени его). Но мембрана постсинаптическая потенциирована, видим ВПСП, котор уменьшается со временем.
Если повысить концентрацию Кальция и дать 500 стимулов, то длительность потенциации увеличится до 2 ч.
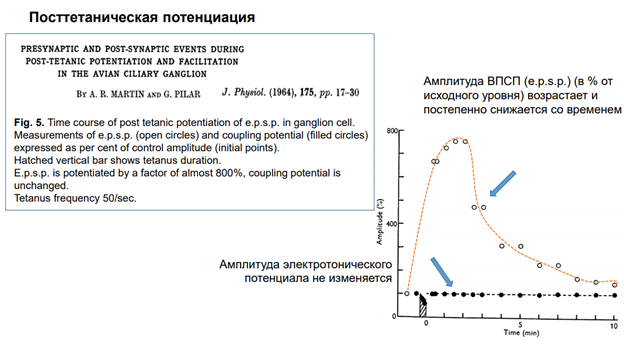
Если отразить предыдущие картинки (фигура справа) на графике, получим вот такую кривулину.
По Оу - амплитуда в %, по Ох – время в мин. За 100% (или за единицу ) принимается нормативный потенциал до воздействия. Потом потенциируем.
В норме – первая точка слева. Тетанус обозначен вертикальной заштрихованной областью на оси Ох. После тетануса практически в 8 раз идет увеличение амплитуды. Это очень существенное увеличение, оно явно не функционально. Фронт быстро нарастает и затихает к 10-ой минуте. Но не возвращается…на картинке, по крайней мере, выходит на плато. Скорее всег отвернётся через большее время в норму.
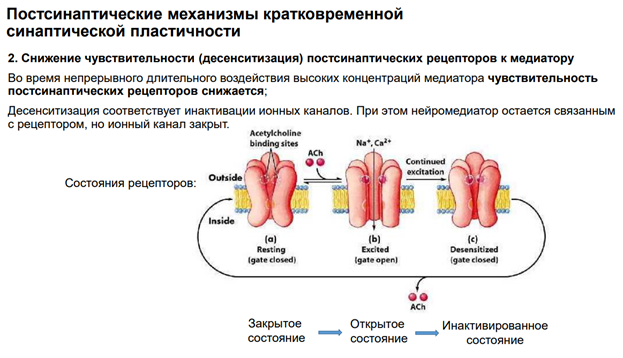
Есть процесс, за счет которого может происходить десенситизация, когда нейрон возвращается в исходное свое положение.
Десенситизация была хорошо описана на ацетилхолиновых рецепторах.
*Десенситизацию можно и на нервно-мышечной передаче можно увидеть.
*чувствительность=афинность не изменится (на слайде не верно написано), т.к чувствительность – это степень связывания.
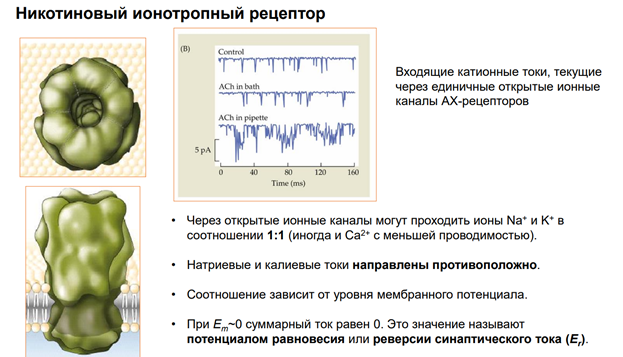
Что происходит? На примере ацетилхолиновых рецепторов. В закрытом состоянии нейромедиатора нет. Под действием ацх открытое состояние, наблюдаем все катионные токи: вход Натрия и Кальция. А если будем дальше продолжать стимуляцию, канал перестанет пропускать катионы («адаптируется»). Если сравнить с потенциал зависимыми Натриевыми каналами , то можно считать, что эта десенситизация соответствует инактивации каналов. Но нейромедиатор остается в канале (см рис самого правого канала). Фактически инактивированнй канал открыт, связан с ацх, но тока нет(!), т.е можно сказать, что он полуоткрыт.
За счет чего это происходит? Один из механизмов инактивации – фосфорилирование субъединиц со стороны цитоплазмы. Это некая защитная реакция рецептора.
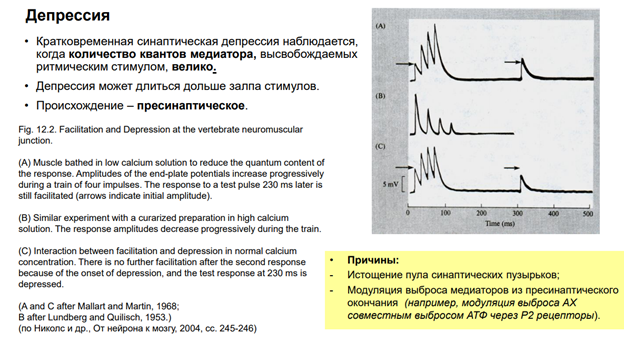
Тут мышца была погружена в Кальциевый раствор. Нужно просто уменьшить вероятность экзоцитоза на стимуляцию, и, естественно, более низкая концентрация Кальция. Это нервно-мышечный препарат.
Смотрим рисунок А. Тут изображена потенциация синапса. Каждый последующий стимул в пачке высокочастотный повышает амплитуду. Если прекратим потенциацию и через некоторе вермя дадим одиночный стимул, получим одиночный пик слегка увеличенной амплитудой.
Рисунок Б. Если окунем в курара. Курара – блокатор. Дадим высокую концентрацию Кальция, получим депрессию. Понятное дело, по мере срабатывания каналов, они все больше закрываются курарином, получаем искусственную депрессию.
Рисунок С. Если суммировать два этих эффекта, получим, что в первые моменты на ритмическую стимуляцию получим потенциацию. Через некоторое время дадим одиночный стимул, получим депрессию.
Причины депрессии: 1) истощение синапт пузырьков, т.к если кальция и так мало, а мы его потратим на синаптич передачу. 2) (см слайд), например, модуляция выброса ацетилхолина … Т.е мы можем подействовать на пресинаптич теримнали через Р2 рецепторы. И через них можно получить обратную регуляцию снижения экзоцитоза (ретроградная регуляция выброса медиатора другим медиатором). АТФ – известна нам как источник энергии (одна из главных функций в нервной системе), но в то же время у него есть нейромдиаторная функция через соответсвующие рецепторы. И АТФ содержится практически во всех везикулах, куда закачан нейромедиатор (закон/ принцип Деила).
Принцип Деила: в везикулах может быть более чем 1 молекула нейромедиатора/ полипептиды и т.д
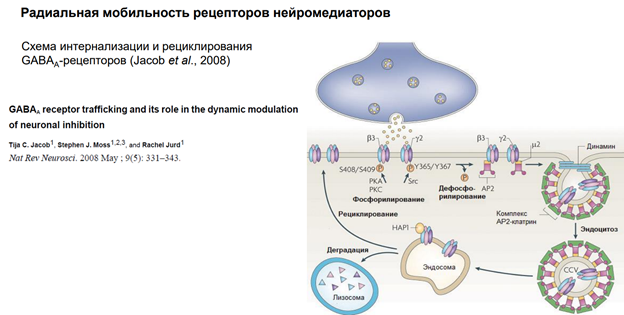
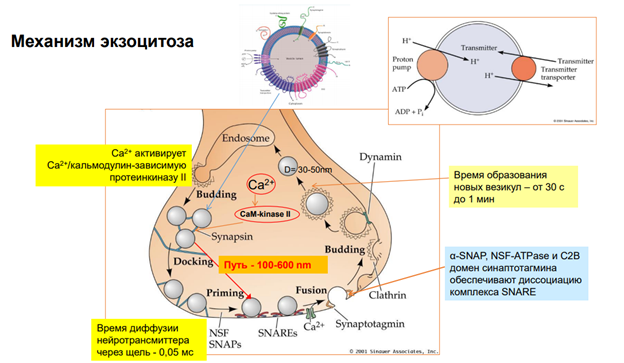
Радиальная мобильность рецепторов нейромедиаторов.
На примере ГАМКа рецептора. Тормозный медиатор.
На рисунке изображена пресинаптическая терминаль, выделяется ГАМК на рецепторы. Рецепторы фосфорилированы. Если их дефосфорилировать (оно может быть в результате активации этих рецепторов) (S408/S409 и Y365/Y367 показывают место в субъединице) …
АР2 – молекула, выполняющая адаптерную функцию для клатрина. Т.е. рецепторы, когда дефосфорилируются, к ним прицепляется адаптерный белок 2 (АР2)
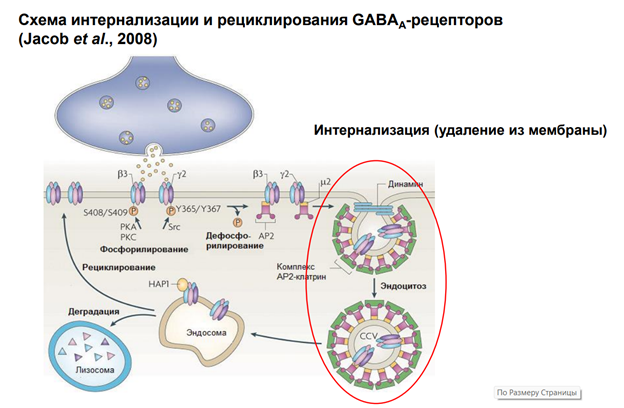
Далее к участку прикладывается молекула клатрина через адаптерный белок и происходит втягивание – эндосомальный процесс… Т.е. несколько рецепторов, которые связались с адаптерным белком, цепляют молекулы клатрина, и утаскиваются внутрь. Эти адаптерные белки сопряжены еще с мембраной (см рис, там они прям на внутренней поверхности мембраны сидят на стадии, когда пошел эндосомальный процесс). В общем, рецепторы утянулсь в просвет полупузырька.
Далее белок динамин обеспечивает схлопывание краев пузырька. После этого рецепторы оказываются внутри эндсомы.
Такой процесс называется интернализация. Он универсальный. Тут нарисованы ионотропные рецепторы. На самом деле, метаботропные рец-ры также могут удаляться из пресинаптической мембраны.
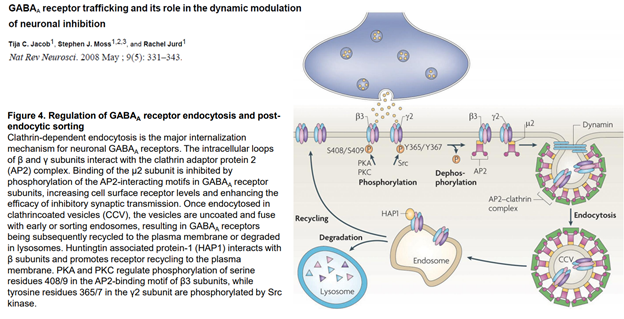
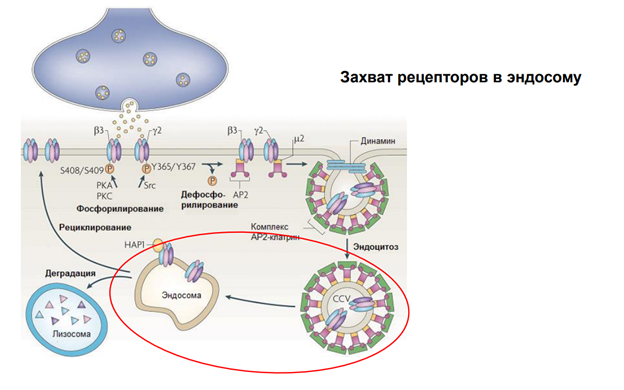
После этого везикула с рецепторами поглощается эндосомой. Соединяется просто и все. Что с рецепторами? Они могут деградироваться, т.е как бы исчезать. И , собственно, всё.
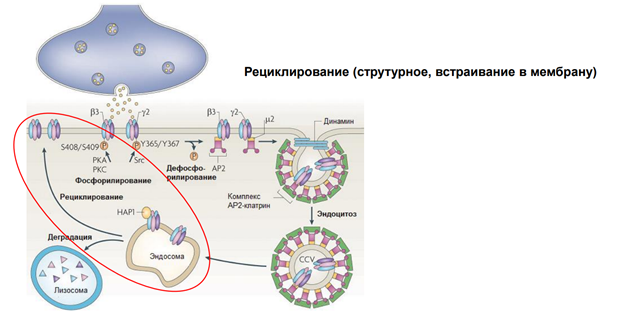
Тут изображена иная их судьба. У них три судьбы, на самом деле.
1) Деградация, 2) рециклирование…
Они могут вернуться в мембрану – рециклирование.
Каким образом еще могут быть получены рецепторы в мембрану? За счет их синтеза. Опускаем тут этот процесс, т.к он требует активации генома, экспрессии генов, которые увеличивают синтез белков, и они встраиваются с помощью эндосом, но берутся они не из мембраны, а с ЭндоПлазматического Ретикулма.
Ну и после фосфорилирования новые рецепторы становятся функциональны.
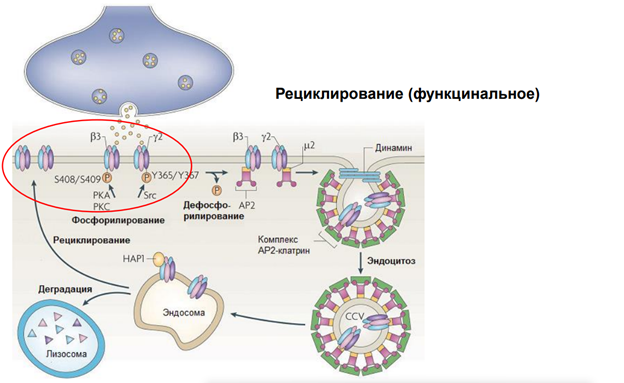
Как можно повлиять на этот процесс? Можно разными способами. Тут опущены транспортные системы, которые обеспечивают такое движение рецепторов.. Поскольку в клетке просто так ничего не плавает. Есть денеины и кинезины, есть актиновые нити.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|