
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 4. ЭЛЕМЕНТЫ КИНЕТИЧЕСКОЙ ТЕОРИИ. И ГАЗОВЫЕ ЗАКОНЫ. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПУТИ
Лекция 4
ЭЛЕМЕНТЫ КИНЕТИЧЕСКОЙ ТЕОРИИ
И ГАЗОВЫЕ ЗАКОНЫ
СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПУТИ
Тепловое движение молекул сопровождается не только ударами молекул о стенки сосуда, в котором заключен газ, но и их взаимными столкновениями. Вследствие этого путь молекулы газа при тепловом движении представляет собой, вообще говоря, пространственную ломаную линию, прямолинейные участки которой соответствуют свободному пути молекулы (без столкновений) (рис. 2); точки, где молекула меняет свое направление, соответствуют моментам столкновения данной молекулы с какой-либо другой. Поскольку тепловое движение беспорядочно, прямолинейные пути молекул между двумя столкновениями не могут быть одинаковы; тем не менее благодаря существованию определенного закона распределения мы и здесь сможем аналогично понятию о средней скорости теплового движения ввести понятие о среднем расстоянии, проходимом молекулами между двумя столкновениями, или, короче, о средней длине свободного пути молекул газа (обозначим ее через l).

Как уже отмечалось, с целью упрощения обычно полагают, что молекулы имеют сферическую форму и что молекулы взаимодействуют друг с другом подобно твердым абсолютно упругим телам, т.е. взаимодействие имеет место только при расстоянии между центрами молекул, меньшем эффективного диаметра молекулы s. Столкновение между молекулами можно строго описать с помощью эффективной поверхности, равной ps2.
Пренебрегая распределением молекул по скоростям, при дальнейшем рассуждении полагаем, что молекулы движутся в случайных направлениях с одинаковой скоростью, равной их средней скорости. Отсюда:
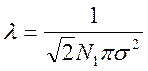 (1.22)
(1.22)
Где l – средняя длина свободного пробега, N1 – число молекул в единице объема, s – эффективный диаметр молекулы.
Для учета влияния температуры на s в формулу вводят поправочный коэффициент (С), полученный экспериментально:
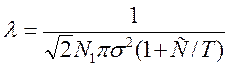
где Т – температура, К; С – постоянная, зависящая от рода газа.
Т.е. l воздуха при Т = 298 К и давлении 105 Па равна
l298 = 6,2×10-8 м
Теперь нужно учесть давление.
Известно, что N1 = p/kT и N1=N/V, т.е.
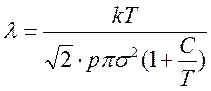
Следовательно, среднюю длину свободного пути молекул воздуха при любом давлении можно определить по уравнению:
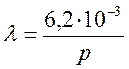 , м
, м
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|